
 研究表明,在CuZnO催化劑存在下,CO2和H2可發生兩個平行反應,分別生成CH3OH和CO,反應的熱化學方程式如下:
研究表明,在CuZnO催化劑存在下,CO2和H2可發生兩個平行反應,分別生成CH3OH和CO,反應的熱化學方程式如下:| T(K) | 催化劑 | CO2轉化率(%) | 甲醇選擇性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
分析 (1)正極是氧氣發生還原反應,正極反應式為O2+4e-+2H2O=4OH-;研究證實,CO2也可在酸性水溶液中通過電解生成甲醇,碳的化合降低發生還原反應,所以生成甲醇的反應發生在陰極,該電極反應式是CO2+6e-+6H+=CH3OH+H2O;
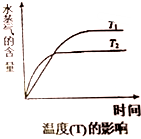
(2)圖中T2>T1,溫度越高水蒸氣的含量越少,平衡逆向移動,所以正反應是放熱反應,由圖可知提高CO2轉化成CH3OH的選擇性,應使平衡向正向移動,可降低溫度,在Cat.2催化劑的條件下選擇性最高;
(3)由CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 平衡常數K1 反應Ⅰ;
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ•mol-8平衡常數K2 反應Ⅱ;
所以根據蓋斯定律CO(g)+2H2(g)?CH3OH(g)△H3=△H1-△H2,K3=$\frac{{K}_{1}}{{K}_{2}}$;
(4)①圖中T2>T1,溫度越高水蒸氣的含量越少,平衡逆向移動,所以正反應是放熱反應,所以△H1<0;
②A.降低反應溫度,平衡正向移動,CO2平衡轉化率增大;
B.在恒壓密閉容器中,投料比不變,增加反應物的濃度,CO2平衡轉化率不變;
C.增大CO2和H2的初始投料比,二氧化碳轉化率降低,而氫的轉化率增大;
D.混合氣體中摻入一定量惰性氣體,相當于減小壓強,平衡逆向移動,二氧化碳轉化率降低;
(5)在T1溫度時,將1.00molCO2和3.00molH2充入體積為1.00L的恒容密閉容器中,容器起始壓強為P0,僅進行反應I.
①容器的壓強與起始壓強之比為等于物質的量之比;
②v=$\frac{△c}{△t}$,求H2的平均反應速率;該溫度下反應的化學平衡常數K=$\frac{平衡時生成物的濃度冪之積}{平衡時反應物的濃度冪之積}$;Kp=$\frac{P({H}_{2}O)•P(C{H}_{3}OH)}{P(C{O}_{2})•{P}^{3}({H}_{2})}$.
解答 解:(1)正極是氧氣發生還原反應,正極反應式為O2+4e-+2H2O=4OH-;研究證實,CO2也可在酸性水溶液中通過電解生成甲醇,碳的化合降低發生還原反應,所以生成甲醇的反應發生在陰極,該電極反應式是CO2+6e-+6H+=CH3OH+H2O,故答案為:O2+4e-+2H2O=4OH-;陰; CO2+6e-+6H+=CH3OH+H2O;
(2)圖中T2>T1,溫度越高水蒸氣的含量越少,平衡逆向移動,所以正反應是放熱反應,由圖可知提高CO2轉化成CH3OH的選擇性,應使平衡向正向移動,可降低溫度,在Cat.2催化劑的條件下選擇性最高,故答案為:使用Cat2催化劑(或理想催化劑);溫度為543K(或降低溫度);
(3)由CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1 平衡常數K1 反應Ⅰ;
CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ•mol-8平衡常數K2 反應Ⅱ;
所以根據蓋斯定律CO(g)+2H2(g)?CH3OH(g)△H3=△H1-△H2,K3=$\frac{{K}_{1}}{{K}_{2}}$,故答案為:$\frac{{K}_{1}}{{K}_{2}}$;
(4)①圖中T2>T1,溫度越高水蒸氣的含量越少,平衡逆向移動,所以正反應是放熱反應,所以△H1<0,故答案為:<;
②A.降低反應溫度,平衡正向移動,CO2平衡轉化率增大,故正確;
B.在恒壓密閉容器中,投料比不變,增加反應物的濃度,CO2平衡轉化率不變,故錯誤;
C.增大CO2和H2的初始投料比,二氧化碳轉化率降低,而氫的轉化率增大,故錯誤;
D.混合氣體中摻入一定量惰性氣體,相當于減小壓強,平衡逆向移動,二氧化碳轉化率降低,故錯誤;
故選A;
(5)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
c(初):1 3 0 0
c(變):a 3a a a
c(平):1-a 3-3a a a
所以$\frac{{P}_{0}}{P}=\frac{4}{4-2a}$,則$\frac{P}{{P}_{0}}$=$\frac{2-a}{2}$,故答案為:$\frac{2-a}{2}$;
②平衡后,混合氣體物質的量為3.00mol,則反應的氫氣的物質的量為1.5mol,v=$\frac{△c}{△t}$=$\frac{\frac{1.5mol}{1L}}{3h}$=0.5mol•L-1•h-1;
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
c(初):1 3 0 0
c(變):0.5 1.5 0.5 0.5
c(平):0.5 1.5 0.5 0.5
所以K=$\frac{0.5×0.5}{0.5×1.{5}^{3}}$=0.148(L•mol-1)2;因為:$\frac{P}{{P}_{0}}$=$\frac{1.5}{2}$,所以P=0.75P0,Kp=$\frac{P({H}_{2}O)•P(C{H}_{3}OH)}{P(C{O}_{2})•{P}^{3}({H}_{2})}$=$\frac{\frac{0.5}{3}×\frac{1.5}{2}×{P}_{0}×\frac{0.5}{3}×\frac{1.5}{2}×{P}_{0}}{\frac{0.5}{3}×\frac{1.5}{2}×{P}_{0}×(\frac{1.5}{3}×\frac{1.5}{2}{P}_{0})^{3}}$=$\frac{64}{27{P}_{0}^{2}}$,故答案為:0.5mol•L-1•h-1;0.148(L•mol-1)2;$\frac{64}{27{P}_{0}^{2}}$.
點評 本題考查較為綜合,涉及化學平衡的計算,平衡移動以及熱化學方程式、電化學等知識,為高考常見題型,側重于學生的分析能力、計算能力的考查,注意把握蓋斯定律的應用,電解池的工作原理等知識,題目難度中等.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸雨是指pH<7的酸性降水 | |
| B. | 淡水的密度小于海水的密度 | |
| C. | 蒸餾法是海水淡化的方法之一 | |
| D. | 融化的雪水中礦物質含量比深井水中的少 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 31.3 g | B. | 27.9 g | C. | 25.6 g | D. | 19.8 g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 丙烯酸所有原子可能共平面 | |
| B. | 丙烯酸可以發生取代反應 | |
| C. | 丙烯酸可以使酸性高錳酸鉀溶液褪色 | |
| D. | 丙烯酸與HBr發生加成反應只能得到唯一產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸常見的特性是吸水性、脫水性、氧化性 | |
| B. | 濃硫酸也具有酸性,在常溫下能夠與活潑金屬鐵、鋁等反應放出氫氣 | |
| C. | 氟化氫的熱穩定性很好,具有極弱的還原性,為一元弱酸 | |
| D. | SO2、SO3都是酸性氧化物,具有酸性氧化物的通性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4+、HCO3-、SO42-、Cl- | B. | CO32-、Cl-、K+、Na+ | ||
| C. | Na+、SO42-、CO32-、Cl- | D. | SO42-、Fe3+、Na+、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com