

| A. | 鹽酸的物質的量濃度為1 mol•L-1,配制100 mL該溶液可用圖3裝置進行 | |
| B. | P點時反應恰好完全,溶液呈中性 | |
| C. | 曲線a是氫氧化鈉溶液滴定鹽酸的滴定曲線,可在圖2的裝置中進行 | |
| D. | 如果錐形瓶用待測液潤洗,會使測定結果偏高 |
分析 A.根據圖象知,當鹽酸中滴加氫氧化鈉溶液時,溶液的PH=1,則c(HCl)=0.1mol/L,配制100 mL該溶液可用圖3裝置進行;
B.氯化氫和氫氧化鈉都是強電解質,且鹽酸和氫氧化鈉元數相同,當恰好中和時,二者的物質的量相等;
C.根據pH變化曲線知,a是氫氧化鈉溶液滴定鹽酸溶液,b是鹽酸滴定氫氧化鈉溶液;
D.用待測液潤洗錐形瓶,導致待測液的物質的量增大.
解答 解:A.配制100 mL溶液,可選擇100 mL容量瓶,離刻度線1-2cm用膠頭滴管進行定容,但根據曲線可以看出鹽酸溶液的pH=1,pH=-lgC(H+)=1,所以C(HCl)=C(H+)=0.1mol/L,故A錯誤;
B.P點時二者恰好完全中和,鹽酸是一元強酸,氫氧化鈉是一元強堿,當二者恰好中和時,二者反應生成氯化鈉,則溶液呈中性,故B正確;
C.根據圖象知,當a曲線發生中和反應時,溶液的pH=1,說明原溶液是鹽酸,所以a曲線是氫氧化鈉滴定鹽酸的實驗,滴定可在圖2的裝置中進行,故C正確;
D.若用待測液潤洗錐形瓶,會導致待測液中溶質的物質的量增大,滴定時消耗的標準液體積偏大,測定結果偏高,故D正確;
故選A.
點評 本題考查了酸堿中和滴定實驗,根據圖中pH變化曲線確定滴定順序,結合酸堿的性質分析解答,難點是滴定曲線對應的意義判斷,題目難度中等.


科目:高中化學 來源: 題型:選擇題
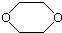 ,是一種常見的有機溶劑,它可以通過下列三步反應制得:
,是一種常見的有機溶劑,它可以通過下列三步反應制得:| A. | 烴A為CH3CH3 | B. | 反應②屬于消去反應 | ||
| C. | 反應①②③都屬于取代反應 | D. | 化合物D屬于醚 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaCO3 | B. | Na2SO3 | C. | H2SO4 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
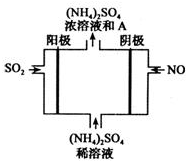 經研究發現,含pM2.5的霧霾主要成分有SO2、NOx、CxHy,及可吸入顆粒等.
經研究發現,含pM2.5的霧霾主要成分有SO2、NOx、CxHy,及可吸入顆粒等.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
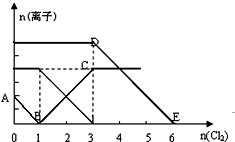 向含有Fe2+、I-、Br-的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.有關說法正確的是( )
向含有Fe2+、I-、Br-的溶液中通入適量氯氣,溶液中各種離子的物質的量變化如圖所示.有關說法正確的是( )| A. | 線段BC代表Cl-數目的變化情況 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 當通入Cl22mol時,溶液中已發生的離子反應可表示為:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
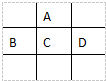 有A、B、C、D、E五種短周期元素,已知相鄰的A、B、C、D四種元素原子核外共有56個電子,在周期表中的位置如圖所示.E的單質可與酸反應,1mol E單質與足量酸作用,在標準狀況下能產生33.6L H2;E的陽離子與A的陰離子核外電子層結構完全相同,回答下列問題:
有A、B、C、D、E五種短周期元素,已知相鄰的A、B、C、D四種元素原子核外共有56個電子,在周期表中的位置如圖所示.E的單質可與酸反應,1mol E單質與足量酸作用,在標準狀況下能產生33.6L H2;E的陽離子與A的陰離子核外電子層結構完全相同,回答下列問題: .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com