
 .
.分析 有A、D、E、X、Y、Z、W七種元素,其中A、D、E、X、Y、Z是原子序數依次增大的短周期主族元素.X原子最外層電子數是其內層電子總數的3倍,由于最外層電子數不超過8,則原子只能有2個電子層,最外層電子數為6,故X為O元素;X、Y同族,則Y為S元素,可推知Z為Cl元素;A與X、Y既不同族也不同周期,則A為H元素;D元素的某種同位素原子在考古方面有重要應用,則D為C元素;E的原子序數介于碳、氧之間,故E為N元素;W是一種常見的金屬,其元素的含量位于地殼中元素含量的第四位,則W為Fe,據此解答.
解答 解:有A、D、E、X、Y、Z、W七種元素,其中A、D、E、X、Y、Z是原子序數依次增大的短周期主族元素.X原子最外層電子數是其內層電子總數的3倍,由于最外層電子數不超過8,則原子只能有2個電子層,最外層電子數為6,故X為O元素;X、Y同族,則Y為S元素,可推知Z為Cl元素;A與X、Y既不同族也不同周期,則A為H元素;D元素的某種同位素原子在考古方面有重要應用,則D為C元素;E的原子序數介于碳、氧之間,故E為N元素;W是一種常見的金屬,其元素的含量位于地殼中元素含量的第四位,則W為Fe.
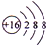
(1)Y為S元素,形成的簡單陰離子結構示意圖為 ,
,
故答案為: ;
;
(2)甲由H、N兩種元素組成,分子中含有18個電子,只存在共價單鍵,常溫下甲是一種無色液體,則甲為N2H4,甲在堿性溶液中能夠將CuO還原為Cu2O,當1molN2H4完全參加反應時轉移了4mol電子,設N元素在氧化產物中化合價為a,由電子轉移守恒則:1mol×2×[a-(-2)]=4mol,故a=0,則反應生成氮氣,還生成水,則該反應的化學方程式為:N2H4+4CuO=N2↑+2Cu2O+2H2O,
故答案為:N2H4+4CuO=N2↑+2Cu2O+2H2O;
(3)處理含CO、SO2煙道氣污染的一種方法,是在催化劑作用下使兩者反應,產物之一為單質硫,碳元素被氧化生成二氧化碳,反應生成1g硫固體單質時放出8.4kJ熱量,則生成1molS(s)放出的熱量為8.4kJ×$\frac{1mol×32g/mol}{1g}$=268.8kJ,此反應的熱化學方程式為:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ•molˉ1 ,
故答案為:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=-268.8 kJ•molˉ1 ;
(4)由鈉和O、Cl三種元素組成的一種陰、陽離子個數之比為1:1的化合物乙,其溶液顯堿性,則該化合物為NaClO,所含的化學鍵類型有:離子鍵、共價鍵,將化合物乙加入到FeCl2的溶液中,當有1mol乙參加反應時轉移2mol電子,亞鐵離子被氧化為+3價,次氯酸根離子還原為氯離子,溶液中發生的離子反應方程式為:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+3Cl-+4Fe3+,
故答案為:離子鍵、共價鍵;6Fe2++3ClO-+3H2O=2Fe(OH)3↓+3Cl-+4Fe3+.
點評 本題考查結構性質位置關系應用,推斷元素是解題關鍵,涉及氧化還原反應、熱化學方程式、核外電子排布等知識點,側重對化學用語的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ②③④⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S+O2═2SO2;△H=-269kJ/mol(反應熱) | |
| B. | 2NO2(g)═O2(g)+2NO(g);△H=+116.2kJ/mol(反應熱) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃燒熱) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和熱) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 實驗數據 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(終讀數) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 鹽酸的物質的量濃度為1 mol•L-1,配制100 mL該溶液可用圖3裝置進行 | |
| B. | P點時反應恰好完全,溶液呈中性 | |
| C. | 曲線a是氫氧化鈉溶液滴定鹽酸的滴定曲線,可在圖2的裝置中進行 | |
| D. | 如果錐形瓶用待測液潤洗,會使測定結果偏高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
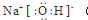 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作設計 | 現象記錄 | 結論解釋 |
| A | 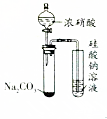 打開分液漏斗 | 右側試管中出現白色沉淀 | 酸性:HNO3>H2CO3>H2SiO3 |
| B | 向稀硝酸和稀硫酸中分別加入鐵粉 | 均有氣泡冒出 | 兩者均發生氧化還原反應 |
| C | 將SO2通入Ba(NO3)3溶液中 | 有白色沉淀生成 | 白色沉淀是BaSO3 |
| D | 向盛有Fe(NO3)3溶液的試管中加入0.1mol•LH2SO4溶液 | 試管口出現紅棕色氣體 | 溶液中NO3-被Fe2+ 還原為NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com