
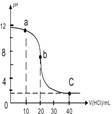
| A. | a點時,溶液呈堿性,溶液中c(B+)>c(Cl-) | |
| B. | b點時溶液的pH=7 | |
| C. | 當c(B+)=c(Cl-)時,v(HCl)<20mL | |
| D. | c點時溶液的c(H+)約為0.03mol•L-1 |
分析 滴定開始前0.1mol/L的BOH溶液的pH小于12,則BOH堿為弱堿,
A.a點容易的pH大于7,溶液呈堿性,根據電荷守恒可知c(B+)>c(Cl-);
B.b點為滴定終點,恰好反應生成強酸弱堿鹽,水解呈酸性;
C.c(B+)=c(Cl-)時根據電荷守恒可知c(H+)=c(OH-),此時溶液為中性,而恰好反應時溶液為堿性,則該點在b點之前;
D.c點加入鹽酸為40mL,根據酸堿溶液的體積計算出混合液中氫離子濃度.
解答 解:滴定開始前0.1mol/L的BOH溶液的pH小于12,則BOH堿為弱堿,
A.a點為BOH-BCl共存的溶液,呈堿性,故有c(B+)>c(Cl-),故A正確;
B.b點為滴定終點,生成強酸弱堿鹽,水解呈酸性,故pH<7,故B錯誤;
C.當c(B+)=c(Cl-)時,根據電荷守恒可知c(H+)=c(OH-),溶液為中性,其pH=7,恰好反應時溶液為堿性,則該點在b點之前,故V<20mL,故C正確;D.c點加入鹽酸為40mL,此時c(H+)=$\frac{0.1×40-0.1×20}{60}$mol/L≈0.03mol/L,故D正確;
故選B.
點評 本題考查了酸堿混合的定性判斷及溶液pH的計算,題目難度中等,明確圖象曲線中各點溶液pH、溶質組成為解答關鍵,注意掌握溶液酸堿性與溶液pH的關系及計算方法,試題培養了學生的分析能力及靈活應用能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL 1mol•L-1Fe2(SO4)3溶液中,Fe3+和SO42-離子數的總和是NA | |
| B. | 室溫下,pH=13的NaOH溶液中含OH-數目為NA | |
| C. | 室溫下,1L pH=12的Ba(OH)2溶液中OH-數目為0.2NA | |
| D. | 室溫下,1L pH=1的鹽酸中,由水電離的H+數目為10-13NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
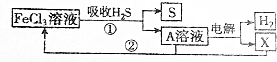
| A. | A溶液中溶質的成分為FeCl2 | B. | X為Cl2并且在陰極上生成的 | ||
| C. | 廢氣中的H2S最終轉化為S和H2 | D. | 只有流程①為氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | z>y>x | B. | x=y>2z | C. | x=y<$\frac{z}{2}$ | D. | x=y>$\frac{z}{2}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
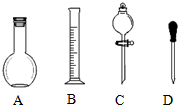 實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.
實驗室需要0.1mol/L NaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根據這兩種溶液的配制情況回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.0mol | B. | 2.5mol | C. | 1.0mol | D. | 0.75mol |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com