

分析 (1)根據蓋斯定律進行計算,由(②+①)÷2-③得出正確結論,反應自發進行的判斷依據是△H-T△S<0,反應能自發進行;
(2)由曲線Ⅰ可知:T2溫度下,5min時測得的甲醇的轉化率為60%,故轉化的甲醇的物質的量為0.20mol×60%=0.12mol,則生成乙酸的物質的量為0.12mol,根據v=$\frac{△c}{△t}$進行計算;
(3)根據甲醇的轉化率計算平衡時各物質的濃度,再根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積計算平衡常數;平衡狀態時,正逆反應速率相等;
(4)由曲線Ⅰ可知:T1-T2階段,5min時,反應未達平衡狀態,故升高溫度,化學反應速率加快,甲醇轉化率隨溫度的升高而增大;
(5)根據濃度商與平衡常數的大小關系,判斷反應進行的方向,原平衡體系,氣體總的物質的量為0.08mol+0.1mol=0.18mol,體積為2L,在溫度為T2時,往上述達到平衡的恒壓容器中,再在瞬間通入0.12molCH3OH和0.06molCO混合氣體,充入氣體總的物質的量為0.12mol+0.06mol=0.18mol,原平衡相等,故體積變為原來的2倍,此時,甲醇的物質的量為0.08mol+0.12mol=0.2mol,CO的物質的量為0.1mol+0.06mol=0.16mol;
(6)當時間到達t1時,將該反應體系溫度迅速上升到T3,并維持該溫度,溫度升高,平衡逆向移動,乙酸的物質的量減小,一段時間后達到平衡狀態,乙酸的物質的量保持不變,據此畫出變化圖象;
解答 解:(1)①2CO(g)+O2(g)=2CO2(g)△H=-560kJ•mol-1
②2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l)△H=-1530kJ•mol-1
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870kJ•mol-1
由(②+①)÷2-③得,CH3OH(g)+CO(g)?CH3COOH(l)△H=$\frac{(-560KJ/mol)+(-1530KJ/mol)}{2}$-(-870kJ•mol-1)=-175kJ•mol-1,
CH3OH(g)+CO(g)?CH3COOH(l)△H=-175kJ•mol-1,△H<0,△S<0,則滿足△H-T△S<0的條件是低溫下反應自發進行,
故答案為:-175,低溫;
(2)由曲線Ⅰ可知:T2溫度下,5min時測得的甲醇的轉化率為60%,故轉化的甲醇的物質的量為0.20mol×60%=0.12mol,則生成乙酸的物質的量為0.12mol,故在溫度為T3時,從反應開始至5min時,用單位時間內物質的量變化表示的乙酸的平均反應速率為$\frac{0.12mol}{5min}$=0.024mol•min-1,
故答案為:0.024;
(3)由解答(2)可知:在溫度為T2時,轉化的甲醇的物質的量為0.12mol,則轉化的CO的物質的量為0.12mol,故平衡時甲醇的物質的量為0.20mol-0.12mol=0.08mol,CO的物質的量為0.22mol-0.12mol=0.1mol,故平衡常數K=$\frac{1}{[C{H}_{3}OH][CO]}$=$\frac{1}{\frac{0.08}{2}×\frac{0.1}{2}}$=500;
在T3溫度下,C點時反應已達平衡狀態,故正逆反應速率相等,故v(正)=v(逆),
故答案為:500;=;
(4)由曲線Ⅰ可知:T1溫度下,5min時,反應未達平衡狀態,故升高溫度,化學反應速率加快,故甲醇轉化率隨溫度的升高而增大,
故答案為:反應未達平衡狀態,故升高溫度,化學反應速率加快,故甲醇轉化率隨溫度的升高而增大;
(5)原平衡體系,氣體總的物質的量為0.08mol+0.1mol=0.18mol,體積為2L,在溫度為T2時,往上述達到平衡的恒壓容器中,再在瞬間通入0.12molCH3OH和0.06molCO混合氣體,充入氣體總的物質的量為0.12mol+0.06mol=0.18mol,原平衡相等,故體積變為原來的2倍,此時,甲醇的物質的量為0.08mol+0.12mol=0.2mol,CO的物質的量為0.1mol+0.06mol=0.16mol,則Qc=$\frac{1}{\frac{0.2}{4}×\frac{0.16}{4}}$=500=K,故平衡不移動;
故答案為:不移動;加入氣體的總物質的量與原平衡氣體的總物質的量相等,體積變為4L,Qc=Qc=$\frac{1}{\frac{0.2}{4}×\frac{0.16}{4}}$=500=K;
(6)當時間到達t1時,將該反應體系溫度迅速上升到T3,并維持該溫度,溫度升高,平衡逆向移動,乙酸的物質的量減小,一段時間后達到平衡狀態,乙酸的物質的量保持不變,故t1時刻后的變化總趨勢曲線為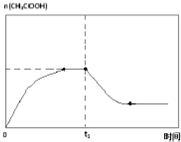 ,故答案為:
,故答案為: .
.
點評 本題考查蓋斯定律的應用、平衡圖象分析、平衡常數的計算機化學平衡移動原理,難度較大.要注意根據濃度商與平衡常數來判斷反應進行的方向.


 同步練習河南大學出版社系列答案
同步練習河南大學出版社系列答案 同步練習西南師范大學出版社系列答案
同步練習西南師范大學出版社系列答案 補充習題江蘇系列答案
補充習題江蘇系列答案 學練快車道口算心算速算天天練系列答案
學練快車道口算心算速算天天練系列答案科目:高中化學 來源: 題型:填空題
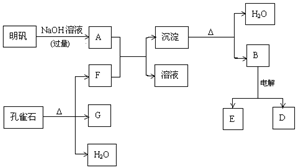
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
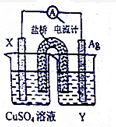 I、依據氧化還原反應:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)設計的原電池如圖所示.請回答下列問題:
I、依據氧化還原反應:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)設計的原電池如圖所示.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | ||
| Z | W | Q |
| A. | X、W能與鈉形成摩爾質量相同的化合物 | |
| B. | 含X和Z元素的常見化合物為分子晶體 | |
| C. | 最高價氧化物對應的水化物酸性:W>Q | |
| D. | 原子半徑大小關系:Q>W>Z>Y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 裝置①可用于實驗室制取乙酸乙酯 | |
| B. | 裝置②可用于分離苯和硝基苯的混合物 | |
| C. | 裝置③可用于以苯為原料萃取碘水中的碘 | |
| D. | 裝置④可用于實驗室制取乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 比苯酚溶液大 | B. | 比苯酚溶液小 | ||
| C. | 與苯酚溶液相等 | D. | 無法和苯酚溶液比較 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
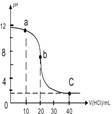
| A. | a點時,溶液呈堿性,溶液中c(B+)>c(Cl-) | |
| B. | b點時溶液的pH=7 | |
| C. | 當c(B+)=c(Cl-)時,v(HCl)<20mL | |
| D. | c點時溶液的c(H+)約為0.03mol•L-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com