
 .
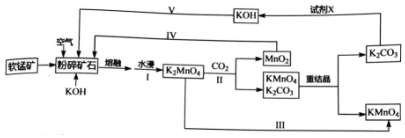
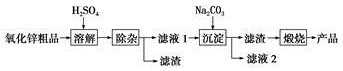
.分析 軟錳礦的主要成分為MnO2,由工藝流程轉化關系可知,MnO2、KOH的熔融混合物中通入空氣時發生反應生成K2MnO4,向K2MnO4溶液中通入CO2制備KMnO4、還生成K2CO3、MnO2,通過過濾,分離出二氧化錳,濾液中含KMnO4和K2CO3,根據KMnO4和K2CO3在溶解性上不同采用蒸發結晶的方式可分離出高錳酸鉀和碳酸鉀,對粗高錳酸鉀進行重結晶、干燥得到純凈的高錳酸鉀;向碳酸鉀溶液中加入石灰生成碳酸鈣和氫氧化鉀,據此分析.
解答 解:(1)KOH為離子化合物,由鉀離子和氫氧根離子構成,氫氧化鉀的電子式為: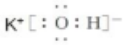 ;
;
故答案為: ;
;
(2)由工藝流程轉化關系可知,MnO2、KOH的熔融混合物中通入空氣時發生反應生成K2MnO4,根據元素守恒還應生成水.反應中錳元素由+4價升高為+6價,總升高2價,氧元素由0價降低為-2價,總共降低4價,化合價升降最小公倍數為4,所以MnO2系數2,O2系數為1,根據錳元素守恒確定K2MnO4系數為2,根據鉀元素守恒確定KOH系數為4,根據氫元素守恒確定H2O系數為2,所以反應化學方程式為:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
故答案為:2MnO2+4KOH+O2$\frac{\underline{\;熔融\;}}{\;}$2K2MnO4+2H2O;
(3)試劑X是將碳酸鉀反應生成氫氧化鉀,所以從經濟性考慮試劑X宜選擇石灰乳(或生石灰),上述流程中,步驟IV和V都是物質循環利用,其目的是循環利用二氧化錳、氫氧化鉀,提高原料利用率;
故答案為:石灰乳(或生石灰);循環利用二氧化錳、氫氧化鉀,提高原料利用率;
(4)pH=10時c(OH-)=10-4mol/L,根據Ksp[Mn(OH)2]=c2(OH-)×c(Mn2+)可知,溶液中c(Mn2)=$\frac{2.0×1{0}^{-13}}{(1{0}^{-4})^{2}}$=2.0×10-5mol•L-1;
故答案為:2.0×10-5mol•L-1;
(5)用高錳酸鉀溶液滴定硫酸錳溶液,產生黑色沉淀,高錳酸根離子與錳離子發生價態歸中反應,發生反應的離子方程式為2MnO4-?+3Mn2++2H2O=5MnO2↓+4H+;
故答案為:2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;
(6)電解錳酸鉀溶液時,陽極上錳酸根離子失電子生成高錳酸根離子,電極反應式為MnO42--e-=MnO4-,陰極上水得電子生成氫氣和氫氧根離子,電極反應為2H2O+2e-=H2↑+2OH-,則陰極溶液的pH增大;
故答案為:①MnO42--e-=MnO4-②增大.
點評 本題考查常見氧化劑與還原劑、氧化還原反應、化學計算和對工藝流程的理解、閱讀題目獲取信息的能力等,難度中等,需要學生具有扎實的基礎知識與靈活運用知識解決問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 1 mol O2中含有1.204×1024個氧原子,在標準狀況下占有體積22.4 L | |
| B. | 1 mol O3和1.5 mol O2含有相等的氧原子數 | |
| C. | 等體積、濃度均為1 mol•L-1的磷酸溶液和鹽酸,含有的氫元素質量之比為3:1 | |
| D. | 等物質的量的干冰和葡萄糖(C6H12O6)中所含的碳原子數之比為1:6,氧原子數之比為1:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | -332 | B. | +130 | C. | +332 | D. | -l30 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol NH4+ 所含質子數為10NA | |
| B. | 10克氖氣所含原子數約為6.02×1023 | |
| C. | 常溫常壓下,22.4 L SO2所含的分子數為NA | |
| D. | 常溫常壓下,32 g O2和O3的混合氣體所含原子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,5.6L二氧化碳氣體中含有的氧原子數為0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氫離子數為0.05NA | |
| C. | 1molFe溶于過量硝酸,電子轉移數為2NA | |
| D. | 標準狀況下,2.24LCC14含有的共價鍵數為0.4NA |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com