
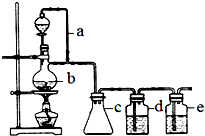
 某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:
某研究性學習小組為合成1-丁醇,查閱資料得知一條合成路線:分析 (1)在題給裝置中,a的作用保持分液漏斗和燒瓶內的氣壓相等,以保證分液漏斗內的液體能順利加入燒瓶中;
(2)實驗時向裝置b中加入幾粒沸石防止瀑沸,加熱后發現未加沸石,應冷卻后再補加;
(3)c主要是起安全瓶的作用,以防止倒吸;
(4)檢驗丙烯和少量SO2、CO2及水蒸氣組成的混合氣體各成分時,應首先選④無水CuSO4檢驗水蒸氣,然后用⑤品紅溶液檢驗SO2,并用①飽和Na2SO3溶液除去SO2;然后用③石灰水檢驗CO2,用②酸性KMnO4溶液檢驗丙烯;濃硫酸和2-丙醇在加熱時發生氧化還原反應生成二氧化硫、二氧化碳和水;
(5)飽和NaHSO3溶液形成沉淀,然后通過過濾即可除去;1-丁醇和乙醚的沸點相差很大,因此可以利用蒸餾將其分離開;
(6)將每一步的利用率或損失率都轉化為起始原料的利用率或損失率,據此計算原料的實際利用率,根據元素守恒計算1-丁醇的質量.
解答 解:(1)為了使分液漏斗中的液體能順利的流下,就必需保持分液漏斗和燒瓶內的氣壓相等,因此a的作用是保持恒壓,
故答案為:平衡壓強,使液體順利流下;
(2)實驗時向裝置b中加入幾粒沸石防止瀑沸,加熱后發現未加沸石,應冷卻后再補加;
故答案為:防止暴沸;停止加熱冷卻后再加入沸石;
(3)c主要是起安全瓶的作用,以防止倒吸,
故答案為:防倒吸,安全瓶作用;
(4)檢驗丙烯可以用酸性KMnO4溶液,檢驗SO2可以用酸性KMnO4溶液褪色、品紅溶液或石灰水,檢驗CO2可以石灰水,檢驗水蒸氣可以無水CuSO4,所以在檢驗這四種氣體必需考慮試劑的選擇和順序,只要通過溶液,就會產生水蒸氣,因此先檢驗水蒸氣;然后檢驗SO2并在檢驗之后除去SO2,除SO2可以用飽和Na2SO3溶液,最后檢驗CO2和丙烯,因此順序為⑤①③②,濃硫酸和2-丙醇在加熱時發生氧化還原反應生成二氧化硫、二氧化碳和水,反應的方程式為CH3CHOHCH3+9H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9SO2+3CO2+13H2O,
故答案為:⑤①③;CH3CHOHCH3+9H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9SO2+3CO2+13H2O;
(5)粗品中含有正丁醛,根據所給的信息利用飽和NaHSO3溶液形成沉淀,然后通過過濾即可除去;由于飽和NaHSO3溶液是過量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因為1-丁醇和乙醚的沸點相差很大,因此可以利用蒸餾將其分離開,
故答案為:飽和NaHSO3溶液;過濾;萃取;蒸餾;
(6)將每一步的利用率或損失率都轉化為起始原料的利用率或損失率,則原料的實際利用率為85%×80%×75%,根據元素守恒及反應方程式可知1-丁醇的質量為85%×80%×75%×$\frac{60g}{60g/mol}×74g/mol$=37.74g,
故答案為:37.74.
點評 本題考查有機物合成方案的設計,題目難度較大,綜合性較強,答題時注意把握物質的分離、提純方法,把握物質的性質的異同是解答該題的關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 向稀HNO3中滴加Na2SO3溶液SO32-+2H+═SO2↑+H2O | |
| B. | CuSO4溶液與H2S反應的離子方程式:Cu2++S2-═CuS↓ | |
| C. | 氯氣溶于水:Cl2+H2═2H++Cl-+ClO- | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某化學課外小組使用鐵絲做催化劑,用下圖裝置制取溴苯,先向分液漏斗中加入苯和液溴,再將混合液慢慢滴入反應器A(A下端活塞關閉)中.
某化學課外小組使用鐵絲做催化劑,用下圖裝置制取溴苯,先向分液漏斗中加入苯和液溴,再將混合液慢慢滴入反應器A(A下端活塞關閉)中.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Al+6HCl═2 AlCl3+3H2 | B. | 4Na+O2═2Na2O | ||
| C. | MgO+H2SO4═MgSO4+2H2O | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗 | 現象 | 結論 |
| A | 將稀硝酸加入過量鐵粉中,充分反應后滴加KSCN溶液 | 有氣體生成,溶液呈紅色 | 稀硝酸將Fe氧化為Fe3+ |
| B | 將銅粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液變藍,有黑色固體出現 | 金屬鐵比銅活潑 |
| C | 用坩堝鉗夾住一小塊用砂紙仔細打磨過的鋁箔在酒精燈上加熱 | 熔化后的液態鋁滴落下來 | 金屬鋁的熔點較低 |
| D | 在相同條件下,分別加熱Na2CO3固體和NaHCO3固體 | NaHCO3固體分解,產生氣體使澄清石灰水變渾濁,Na2CO3固體并沒有分解 | Na2CO3固體的穩定性比NaHCO3好 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 都可以與水反應生成氫氣和堿 | |
| B. | 都能從硫酸銅溶液中置換出銅 | |
| C. | 去除鋁表面的銅鍍層可以選用稀硝酸 | |
| D. | 鐵絲不論在空氣中還是在純氧中都可以發生氧化還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用FeCl3溶液腐蝕銅線路板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | Na2O2與H2O反應制備O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 將氯氣溶于水制備次氯酸:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用濃鹽酸酸化的KMnO4溶液與H2O2反應,證明H2O2具有還原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com