
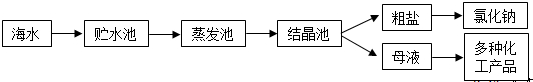
| 離子 | Na+ | Mg2+ | Cl- | SO42- |
| 濃度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
| ||
| ||
| 1 |
| 1+5 |
| 58g |
| 24g |
| m |
| M |
| 69.6g |
| 58g/mol |


 學練快車道快樂假期寒假作業系列答案
學練快車道快樂假期寒假作業系列答案 新思維寒假作業系列答案
新思維寒假作業系列答案科目:高中化學 來源: 題型:
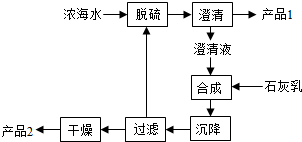
查看答案和解析>>
科目:高中化學 來源: 題型:
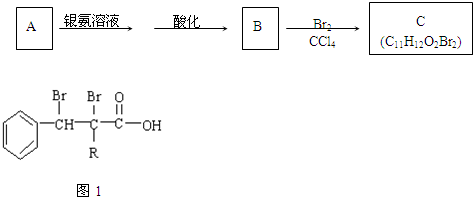
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
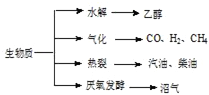
查看答案和解析>>
科目:高中化學 來源: 題型:
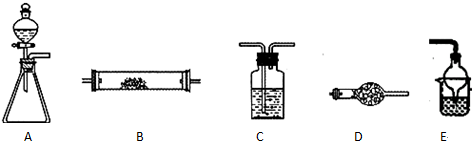
查看答案和解析>>
科目:高中化學 來源: 題型:
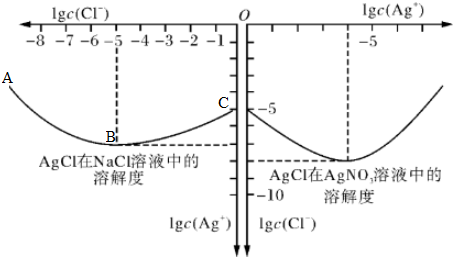
查看答案和解析>>
科目:高中化學 來源: 題型:
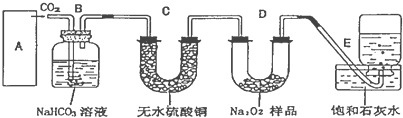
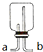 可連接在E處,則Cl2從
可連接在E處,則Cl2從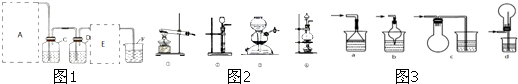
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、Fe2O3 |
| B、FeCl3 |
| C、Fe2(SO4)3 |
| D、FeO |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com