
分析 CO2溶于水中,大部分形成CO2•6H2O,只有一小部分形成H2CO3,經實測K=c(CO2•6H2O)/c(H2CO3)=600,設c(H2CO3)為x,則c(CO2•6H2O)=600x,在常溫常壓下,CO2飽和溶液的濃度約為0.04mo1•L-1,依據碳元素守恒得到,x+600x=0.04,得到x=6.65×10-5mol/L,結合H2CO3?HCO3-+H+ 的平衡常數表達式計算得到K.
解答 解:CO2溶于水中,大部分形成CO2•6H2O,只有一小部分形成H2CO3,經實測K=c(CO2•6H2O)/c(H2CO3)=600,設c(H2CO3)為x,則c(CO2•6H2O)=600x,在常溫常壓下,CO2飽和溶液的濃度約為0.04mo1•L-1,依據碳元素守恒得到,x+600x=0.04,得到x=6.65×10-5mol/L,pH約為4,忽略HCO3-?CO32-+H+ 的電離,則H2CO3?HCO3-+H+ 的平衡濃度為:c(H+)=c(HCO3-)=10-4mol/L,平衡常數表達式計算得到Ka1=$\frac{1{0}^{-4}×1{0}^{-4}}{6.65×1{0}^{-5}}$=1.5×10-4,
故答案為:1.5×10-4;
點評 本題考查了弱電解質電離平衡的分析,飽和溶液中元素守恒的應用,注意平衡常數的計算方法,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | NA個氧氣分子的體積約為11.2L | |
| B. | 1.8g的NH4+離子中含有的電子數為10NA | |
| C. | 標準狀況下,2.24 L氫氣和氧氣以任意比組成的混合氣體,所含的原子數約為0.2NA | |
| D. | 7.8g過氧化鈉固體中含有的陰、陽離子的總數約為0.4 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,11.2 L Cl2通入含0.5molFeBr2的溶液中轉移電子數為1.5NA | |
| B. | 0.1 mol•L-1的AlCl3溶液與足量NaOH溶液反應所得產物中含AlO2-為0.1NA | |
| C. | 足量Zn與濃硫酸共熱可生成標準狀況下的氣體2.24 L,則參加反應的硫酸為0.4 NA | |
| D. | 常溫常壓下,1.6g甲烷中含有的碳原子數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
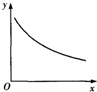 在某密閉容器中充入H2S和O2,發生反應:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,達到平衡后,若僅改變橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢符合圖象的是( )
在某密閉容器中充入H2S和O2,發生反應:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,達到平衡后,若僅改變橫坐標x的值,重新達到平衡后,縱坐標y隨x變化趨勢符合圖象的是( )| 選項 | x | y |
| A | 溫度 | 混合氣體平均相對分子質量 |
| B | 壓強 | S2氣體體積分數 |
| C | 容器體積 | H2S濃度 |
| D | O2濃度 | 平常常數逆反應速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;X元素基態原子的電子排布式為1s22s22p63s23p5.
;X元素基態原子的電子排布式為1s22s22p63s23p5.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 可能存在大量Ba2+ | B. | 溶液中Na+物質的量小于0.12mol | ||
| C. | 可能存在Cl- | D. | 溶液中c(Na+)≥0.6mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2 | |
| B. | C(石墨,s)=C(金剛石,s)△H=+1.9kJ/mol,則可判定金剛石比石墨穩定 | |
| C. | 中和熱的實驗過程中,環形玻璃攪拌棒材料若用銅代替,則測出的中和熱數值偏小 | |
| D. | 已知反應:①101kPa時,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,則C的燃燒熱為110.5kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使酚酞試液變紅的溶液中:S2-、SO42-、SO32-、Na+ | |
| B. | 由水電離出來的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、SO42-、K+ | |
| C. | pH=0的溶液中:Na+、K+、Fe2+、NO3- | |
| D. | pH=7的溶液中:Al3+、Cl-、SO42-、CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
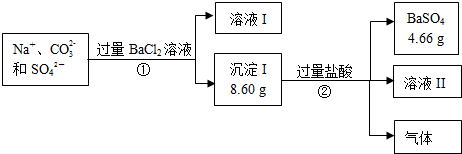
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com