
| A. | 兩種醋酸溶液的物質的量濃度分別為c1和c2,pH分別為a和(a+1),則有c1=10c2. | |
| B. | 10mL0.1mol•L-1CH3COOH溶液加入等物質的量的NaOH后,溶液中有c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在0.1mol•L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) | |
| D. | pH<7的某二元弱酸是酸式鹽NaHA溶液中有c(H+)+2c(A2-)=c(OH-)+c(H2A) |
分析 A.醋酸為弱酸,濃度影響醋酸的電離程度,如:濃度越大,電離程度越小;
B.反應后溶質為醋酸鈉,醋酸根離子部分水解,溶液顯示堿性,c(OH-)>c(H+);
C.根據亞硫酸氫鈉溶液中的物料守恒分析;
D.根據酸式鹽NaHA溶液中電荷守恒和物料守恒進行判斷.
解答 解:A.醋酸溶液中,醋酸是弱電解質,醋酸濃度越大其電離程度越小,所以兩種醋酸溶液的物質的量濃度分別為c1和c2,pH分別為a和a+1,則c1>10c2,故A錯誤;
B.10mL0.1mol•L-1CH3COOH溶液加入等物質的量的NaOH后,二者恰好反應生成醋酸鈉,醋酸根離子部分水解,溶液顯示堿性,則c(OH-)>c(H+),結合電荷守恒可得:c(Na+)>c(CH3COO-),溶液中正確的離子濃度大小為:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故B錯誤;
C.在0.1mol•L-1NaHSO3溶液中,根據物料守恒可得:c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故C正確;
D.pH<7的某二元弱酸的酸式鹽NaHA溶液中,溶液顯示酸性,HA-的水解程度小于電離程度,即c(A2-)>c(H2A);根據電荷守恒可得:c(Na+)+c(H+)=2c(A2-)+c(OH-)+c(HA-),根據物料守恒可得:c(Na+)=c(A2-)+c(H2A)+c(HA-),兩個平衡結合可得:①c(H+)+c(H2A)=c(OH-),若②c(H+)+2c(A2-)═c(OH-)+c(H2A),①-②可得:c(A2-)=c(H2A),而實際上c(A2-)>c(H2A),故D錯誤;
故選C.
點評 本題考查了溶液中離子濃度大小分析,題目難度中等,明確電荷守恒、物料守恒的應用方法為解答關鍵,要求學生能夠利用電荷守恒、物料守恒及鹽的水解比較溶液中離子濃度大小.


科目:高中化學 來源: 題型:填空題
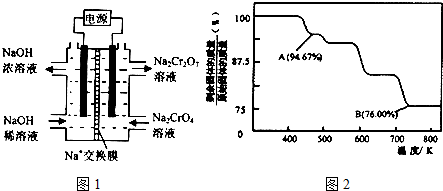
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,CH3COONH4溶液的pH=7,與純水中H2O的電離程度相同 | |
| B. | 向CH3COONH4溶液加入CH3COONa固體時,c(NH4+)、c(CH3COO-)均會增大 | |
| C. | 常溫下,等濃度的NH4Cl和CH3COONa兩溶液的pH之和為14 | |
| D. | 等溫等濃度的氨水和醋酸兩溶液加水稀釋到相同體積,溶液pH的變化值一定相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 現有A、B、C、D、E、F原子序數依次增大的六種元素,它們位于元素周期表的前四周期,B元素含有3個能級,且每個能級所含的電子數相同;D的原子核外有8個運動狀態不同的電子;E元素與F元素處于同一周期相鄰的族,它們的原序數相差3,且E元素的基態原子有4個未成對電子,請回答下列問題:
現有A、B、C、D、E、F原子序數依次增大的六種元素,它們位于元素周期表的前四周期,B元素含有3個能級,且每個能級所含的電子數相同;D的原子核外有8個運動狀態不同的電子;E元素與F元素處于同一周期相鄰的族,它們的原序數相差3,且E元素的基態原子有4個未成對電子,請回答下列問題: .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為了使燃料充分燃燒,通入的空氣要適當過量 | |
| B. | 目前鍋爐燃燒采用沸騰爐的逐漸增多,目的是提高煤炭的熱效率并減少SO2的排放 | |
| C. | 為提高熱能的利用率,可以在煤燃燒后排放廢氣的煙道中安裝熱交換裝置 | |
| D. | 為開發氫能,可研究設法將太陽能聚焦,產生高溫使水分解產生氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
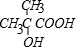 ;b 的結構簡式
;b 的結構簡式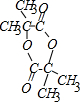 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 改變溫度,反應中轉移電子的物質的量n的范圍:3amol≤n≤5amol | |
| B. | 改變溫度,產物中NaCl的最小理論產量為4amol | |
| C. | 參加反應的氯氣的物質的量3amol | |
| D. | 某溫度下,若反應后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=6,則溶液中$\frac{c(C{l}^{-})}{c(C{O}_{3}^{-})}=\frac{1}{2}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com