
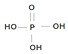
 (為三元中強酸),三聚磷酸可視為三個磷酸分子之間脫去兩個水分子的產物,其結構簡式為
(為三元中強酸),三聚磷酸可視為三個磷酸分子之間脫去兩個水分子的產物,其結構簡式為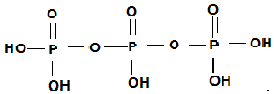 ;三聚磷酸鈉是常用的水處理劑,其化學式為Na5P3O10.
;三聚磷酸鈉是常用的水處理劑,其化學式為Na5P3O10.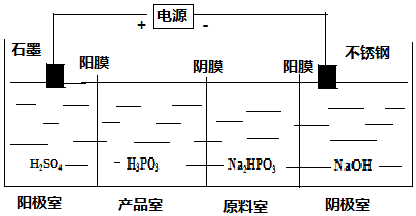
分析 (1)Cu元素的化合價由+2價降低到+1價,CuSO4是氧化劑,P4部分磷元素由0價降低到-3價,部分磷元素由0價升高到+5價,磷元素的化合價既升高又降低,所以P4既是氧化劑又是還原劑,若有11molP4參加反應,其中5mol的P4做氧化劑,據此計算即可;
(2)三聚磷酸可視為三個磷酸分子之間脫去兩個水分子的產物,即磷酸分子間兩個羥基脫去應該水分子;三聚磷酸鈉可以看作三聚磷酸中五個羥基的氫原子換成鈉離子;
(3)若向Na2HPO4溶液中加入足量的CaCl2溶液,HPO42-離子和Ca2+離子反應生成沉淀,促進HPO42-的電離,溶液顯示酸性;
(4)根據氧化還原反應中化合價變化及質量守恒定律判斷反應物和生成物,并配平反應方程式;
(5)亞磷酸和碘發生氧化還原反應,亞磷酸作還原劑被氧化生成磷酸,碘被還原生成氫碘酸,據此寫出反應方程式;陰極上得電子發生還原反應;產品室中HPO32-和氫離子結合 生成亞磷酸.
解答 解:(1)Cu元素的化合價由+2價降低到+1價,CuSO4是氧化劑,P4部分磷元素由0價降低到-3價,部分磷元素由0價升高到+5價,磷元素的化合價既升高又降低,所以P4既是氧化劑又是還原劑,若有11molP4參加反應,其中5mol的P4做氧化劑,60mol硫酸銅做氧化劑,只有6mol的P4做還原劑,所以1mol硫酸銅轉移電子物質的量=1mol×(2-0)=2mol,氧化白磷物質的量=$\frac{1}{4×5}$mol=0.05mol,
故答案為:0.05mol;
(2)磷酸分子間通過羥基脫水形成三聚磷酸,所以三聚磷酸的結構式為: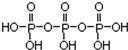 ;三聚磷酸中羥基的氫原子被鈉離子取代生成三聚磷酸鈉(俗稱“五鈉”),所以三聚磷酸鈉的化學式為:Na5P3O10,
;三聚磷酸中羥基的氫原子被鈉離子取代生成三聚磷酸鈉(俗稱“五鈉”),所以三聚磷酸鈉的化學式為:Na5P3O10,
故答案為: ; Na5P3O10;
; Na5P3O10;
(3)HPO42-離子既能發生電離又能發生水解,電離反應式為HPO42-?PO43-+H+,水解反應式為HPO42-+H2O?H2PO4-+OH-,溶液呈堿性,說明水解程度大于電離程度;由于HPO42-離子和Ca2+離子反應生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,促進HPO42-的電離,溶液則顯酸性,
故答案為:Na2HPO4溶液中存在電離平衡:HPO42-?H++PO43-,加入CaCl2溶液,Ca2+與PO43-結合生成Ca3(PO4)2沉淀,促進Na2HPO4的電離平衡向右移動,H+濃度增大,溶液顯酸性;
(4)由氧化還原反應中化合價升降相等進行配平:鎳元素的化合價降低了2價,磷元素的化合價升高的2價,根據原子守恒結合電荷守恒可得配平的方程式為:H2O+Ni2++H2PO2-═Ni+H2PO3-+2H+,故答案為:Ni2++H2PO2-+H2O=Ni+H3PO3+2H+;
(5)亞磷酸和碘發生氧化還原反應,亞磷酸作還原劑被氧化生成磷酸,碘被還原生成氫碘酸,反應方程式為:H3PO3+I2+H2O=2HI+H3PO4,陰極上氫離子得電子發生還原反應,電極反應式為2H++2e-=H2↑,產品室中HPO32-和氫離子結合生成亞磷酸,反應離子方程式為:HPO32-+2H+=H3PO3,故答案為:H3PO3+I2+H2O=H3PO4+2HI;2H++2e-=H2↑;HPO32-+2H+=H3PO3.
點評 本題考查了氧化還原反應的配平、氧化還原反應電子轉移等知識,題目難度中等,試題涉及的內容較多,題量較大,充分考查了學生的分析能力及靈活應用能力.


 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若將容器壓縮時,正逆反應速率均不變 | |
| B. | 5 min內平均反應速率v(X)=0.02 mol/(L•min) | |
| C. | 向平衡后的體系中加入l molM(s),平衡向逆反應方向移動 | |
| D. | 當混合氣體的質量不再發生變化時,說明反應達到平衡狀態 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
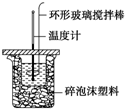 利用如圖所示裝置測定中和熱的實驗步驟如下:
利用如圖所示裝置測定中和熱的實驗步驟如下:| 實驗 序號 | 起始溫度t1/℃ | 終止溫度t2/℃ | |
| 鹽酸 | 氫氧化鈉溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | KCl NaHSO4 KHCO3 | B. | Na2SO4 BaCl2 Na2CO3 | ||
| C. | NaHCO3 Ba(OH)2 NaHSO4 | D. | Ca(OH)2 Na2CO3 BaCl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
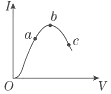 在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力I隨加入水的體積V變化的曲線如圖所示.請完成下列問題:
在一定溫度下,冰醋酸加水稀釋過程中,溶液的導電能力I隨加入水的體積V變化的曲線如圖所示.請完成下列問題:| 酸 | 電離方程式 | 電離平衡常數K |
| CH3COOH | CH3COOH?CH3COO-+H | K=1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-H2CO3-?H++HCO32- | K1=4.31×10-7K2=5.61×10-11 |
| HClO | HClO?H++ClO- | K=3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:2:4 | B. | 1:1:1 | C. | 2:1:2 | D. | 1:2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:1 | B. | 1:2 | C. | 10:1 | D. | 2:1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com