
| A. | 銅與硝酸銀溶液反應:Cu+Ag+═Cu2++Ag | |
| B. | 氫氧化鋇溶液與稀硫酸:H++SO42-+Ba2++OH-═BaSO4+H2O | |
| C. | 醋酸與NaOH的反應:H++OH-═H2O | |
| D. | 碳酸鎂與稀硫酸:MgCO3+2H+═Mg2++H2O+CO2↑ |
分析 A.離子方程式兩邊正電荷不相等,違反了電荷守恒;
B.氫離子、氫氧根離子的系數不滿足硫酸、氫氧化鋇的化學式組成;
C.醋酸為弱酸,離子方程式中需要保留分子式;
D.碳酸鎂與稀硫酸反應生成硫酸鎂、二氧化碳氣體和水.
解答 解:A.銅與硝酸銀溶液反應生成硝酸銅和銀,正確的離子方程式為:Cu+2Ag+═Cu2++2Ag,故A錯誤;
B.氫氧化鋇溶液與稀硫酸反應生成硫酸鋇沉淀和水,正確的離子方程式為:2H++SO42-+Ba2++2OH-═BaSO4+2H2O,故B錯誤;
C.醋酸與NaOH的反應生成醋酸鈉和水,醋酸不能拆開,正確的離子方程式為:CH3COOH+OH-═2CH3COO-+H2O,故C錯誤;
D.碳酸鎂與稀硫酸反應的離子方程式為:MgCO3+2H+═Mg2++H2O+CO2↑,故D正確;
故選D.
點評 本題考查了離子方程式的書寫判斷,為高考的高頻題,屬于中等難度的試題,注意掌握離子方程式的書寫原則,明確離子方程式正誤判斷常用方法:檢查反應能否發生,檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合守恒關系(如:質量守恒和電荷守恒等)、檢查是否符合原化學方程式等.


科目:高中化學 來源: 題型:選擇題
| A. | 吸收29.2kJ熱量 | B. | 放出29.2kJ熱量 | C. | 放出7.3kJ熱量 | D. | 吸收7.3kJ熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6g Fe粉與足量的稀硝酸完全反應,失電子總數為0.2NA | |
| B. | 2NA個二氧化碳分子的質量為44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+與Cl-離子總數為0.2NA | |
| D. | 17g氨氣中所含原子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬單質的熔點隨原子序數的增大而降低 | |
| B. | Cs是第ⅠA族元素,Cs失電子能力比Na的強 | |
| C. | 砹(At)是第VIIA族,其氫化物的穩定性大于HCl | |
| D. | 第三周期金屬元素的最高價氧化物對應水化物,其堿性隨原子序數的增大而減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 遇苯酚變紫色的溶液:Na+、Mg2+、SO42-、Cl- | |
| B. | 使甲基橙變紅色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| C. | 0.1mol/LNaHCO3溶液:K+、AlO2-、Cl-、NO3- | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
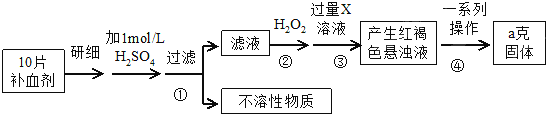
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分液 | B. | 過濾 | C. | 蒸發 | D. | 蒸餾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com