
| 元素 | 相關信息 |
| X | X的最高價氧化為對應的水化物化學式為H2XO3 |
| Y | Y是地殼中含量最高的元素 |
| Z | Z的基態原子最外層電子排布式為3s23p1 |
| W | W的一種核素的質量數為28,中子數為14 |
分析 短周期元素中,Y是地殼中含量最高的元素,則Y為O元素;X的最高價氧化物對應的水化物化學式為H2XO3,則X的最高化合價為+4,結合原子序數Y>X,可確定X為C元素,Z的基態原子最外層電子排布式為3s23p1,即Z為Al元素;W的一種核素的質量數為28,中子數為14,可確定W的質子數為28-14=14,即W為Si,據此解答.
解答 解:短周期元素中,Y是地殼中含量最高的元素,則Y為O元素;X的最高價氧化物對應的水化物化學式為H2XO3,則X的最高化合價為+4,結合原子序數Y>X,可確定X為C元素,Z的基態原子最外層電子排布式為3s23p1,即Z為Al元素;W的一種核素的質量數為28,中子數為14,可確定W的質子數為28-14=14,即W為Si.
(1)Si位于元素周期表第三周期第ⅣA族,同主族元素原子半徑從上到下依次增大,則W(Si)的原子半徑比X(C)的要大,
故答案為:三、ⅣA;大;
(2)因周期元素從左到右,元素的第一電離能呈增大趨勢,故Z(Al) 的第一電離能比W(Si)的要小.XY2(CO2)為分子晶體,由固態變為氣態,克服的是分子間作用力.由C、H、O組成的分子中,存在分子間氫鍵的物質很多,如:CH3CH2OH、CH3COOH等,
故答案為:小;分子間作用力;乙醇、乙酸等;
(3)Al與鹽酸反應生成氯化鋁,向反應后的溶液中滴加NaOH溶液直至過量,發生的反應為:Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,所以看到的現象是:先生成白色沉淀,后沉淀逐漸溶解,最后變成無色溶液,
W單質為硅,硅和氫氟酸反應生成SiF4和H2兩種氣體,反應方程式為:Si+4HF=SiF4↑+2H2↑,
故答案為:先生成白色沉淀,后沉淀逐漸溶解,最后變成無色溶液;Si+4HF=SiF4↑+2H2↑;
(4)13.5g Al的物質的量為$\frac{13.5g}{27g/mol}$=0.5mol,Al完全燃燒后恢復至原狀態放熱419kJ,故4molAl放熱為419×8=3352KJ,所以熱化學方程式為:2Al(s)+3O2(g)=2Al2O3(s)△H=-3352kJ/mol;
故答案為:2Al(s)+3O2(g)=2Al2O3(s)△H=-3352kJ/mol.
點評 本題考查位置結構性質關系應用,明確元素種類是解題關鍵,注意掌握同周期元素第一電離能異常情況,掌握氫鍵對物質性質的影響及其存在情況.


科目:高中化學 來源: 題型:選擇題
| A. | 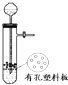 圖所示裝置用于Cu和濃H2SO4反應制取少量的SO2氣體 圖所示裝置用于Cu和濃H2SO4反應制取少量的SO2氣體 | |
| B. | 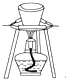 圖所示裝置用于除去碳酸氫鈉固體中的少量碳酸鈉 圖所示裝置用于除去碳酸氫鈉固體中的少量碳酸鈉 | |
| C. | 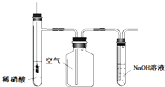 圖所示裝置用于制備并收集NO氣體 圖所示裝置用于制備并收集NO氣體 | |
| D. | 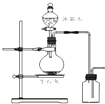 圖所示裝置制取并收集氨氣 圖所示裝置制取并收集氨氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
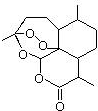
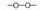 ,需要在有機合成中引入羥基,引入羥基的反應類型有①②⑤.(選填編號)
,需要在有機合成中引入羥基,引入羥基的反應類型有①②⑤.(選填編號)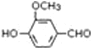 )可用于合成青蒿素,合成天然香草醛的反應如圖:
)可用于合成青蒿素,合成天然香草醛的反應如圖: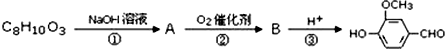
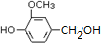 .
.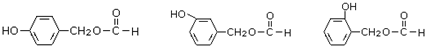 .
.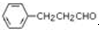 是合成青蒿素的中間原料之一,寫出由苯甲醛和氯乙烷為原料,制備芐基乙醛的合成路線流程圖(無機試劑任用).
是合成青蒿素的中間原料之一,寫出由苯甲醛和氯乙烷為原料,制備芐基乙醛的合成路線流程圖(無機試劑任用).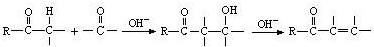
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 化學式 | HCOOH | H2CO3 | HClO |
| 電離平衡常數 | 1.7×10-4 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 將1molH2(g)和2mol I2(g)置于某2L密閉容器中,在一 定溫度下發生反應:H2(g)+I2(g)?2HI(g)△H<0,并達到平衡,HI的體積分數ω(HI)隨時間變化如曲線如圖(Ⅱ)所示.若改變反應條件,ω(HI)的變化曲線如圖(Ⅰ)所示,則改變的條件可能是( )
將1molH2(g)和2mol I2(g)置于某2L密閉容器中,在一 定溫度下發生反應:H2(g)+I2(g)?2HI(g)△H<0,并達到平衡,HI的體積分數ω(HI)隨時間變化如曲線如圖(Ⅱ)所示.若改變反應條件,ω(HI)的變化曲線如圖(Ⅰ)所示,則改變的條件可能是( )| A. | 恒溫恒容加入適當催化劑 | B. | 恒溫條件縮小體積 | ||
| C. | 恒容條件下升高溫度 | D. | 恒溫條件擴大反應容器 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干冰用于人工降雨 | |
| B. | 蔗糖中加入濃硫酸,蔗糖變黑,體積膨脹 | |
| C. | 溶洞中鐘乳石的形成 | |
| D. | 豆科作物的根瘤菌對空氣中氮的固定 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
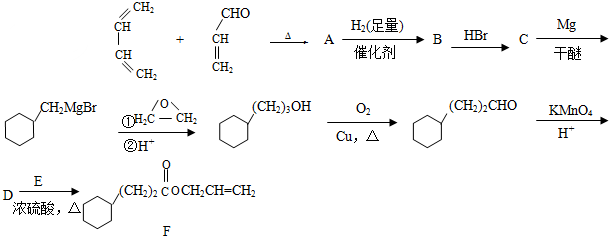
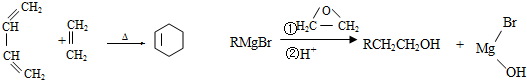
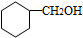 .
. .
. .
.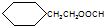
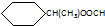 .
.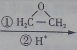 CH3CH2CH2CH2OH(其他試劑任選).
CH3CH2CH2CH2OH(其他試劑任選).查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com