
【題目】實(shí)驗(yàn)室需要 0.5mol/L的硫酸溶液500mL。根據(jù)溶液的配制情況回答下列問題。
(1)根據(jù)計(jì)算得知,需量取質(zhì)量分?jǐn)?shù)為98%、密度為1.84g/cm3的濃硫酸的體積為________mL。
(2)在如圖所示儀器中,配制上述溶液肯定不需要的有_________(填序號(hào))
A.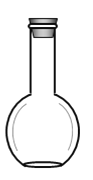 B.
B. C.
C.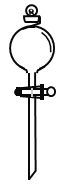 D.
D.![]()
(3)實(shí)驗(yàn)操作步驟為:
A.把制得的溶液小心地轉(zhuǎn)移至容量瓶中。
B.量取所需濃硫酸 ,在燒杯中用適量的蒸餾水將它稀釋并冷卻至室溫。
C.繼續(xù)向容量瓶中加蒸餾水至液面距刻度1~2cm處,改用膠頭滴管小心滴加蒸餾水至溶液凹液面底部與刻度線相切。
D.用少量蒸餾水洗滌燒杯和玻璃棒2~3次,每次洗滌的液體都小心注入容量瓶,并輕輕振蕩。
E.將容量瓶塞塞緊,充分搖勻。
操作步驟的正確順序?yàn)?/span>_______(填序號(hào))。
(4)下列情況中,會(huì)使所配溶液濃度偏高的是_______(填序號(hào))。
A.量取所需濃硫酸某同學(xué)觀察液面時(shí)仰視
B.沒有進(jìn)行上述的操作步驟D
C.加蒸餾水時(shí),不慎超過了刻度線
D.容量瓶使用前內(nèi)壁沾有水珠
E.用少量蒸餾水洗滌量取濃硫酸后的量筒,洗滌的液體注入容量瓶
【答案】13.6 C BADCE AE
【解析】
(1)先求出質(zhì)量分?jǐn)?shù)為98%、密度為1.84g/cm3的濃硫酸的物質(zhì)的量濃度,再根據(jù)稀釋定律求出配制0.5mol/L的硫酸溶液500mL需要的濃硫酸的體積。
(2)配制一定物質(zhì)的量濃度溶液需要用到容量瓶、量筒、膠頭滴管、燒杯、玻璃棒,不需要用分液漏斗。
(3)根據(jù)配制一定物質(zhì)的量濃度的溶液的實(shí)驗(yàn)操作步驟排序。
(4)根據(jù)c=![]() ,若n偏大或V偏小,都會(huì)使所配溶液濃度偏高,據(jù)此分析。
,若n偏大或V偏小,都會(huì)使所配溶液濃度偏高,據(jù)此分析。
(1)質(zhì)量分?jǐn)?shù)為98%、密度為1.84g/cm3的濃硫酸的物質(zhì)的量濃度為c=![]() =
=![]() mol/L=18.4mol/L,配制0.5mol/L的硫酸溶液500mL,根據(jù)稀釋前后溶質(zhì)的物質(zhì)的量不變,需要的濃硫酸的體積為
mol/L=18.4mol/L,配制0.5mol/L的硫酸溶液500mL,根據(jù)稀釋前后溶質(zhì)的物質(zhì)的量不變,需要的濃硫酸的體積為![]() =13.6mL。
=13.6mL。
(2)用濃硫酸配制稀硫酸,需要用量筒量取濃硫酸的體積,倒入盛水的燒杯中,同時(shí)用玻璃棒攪拌,然后用玻璃棒引流把稀釋并冷卻的硫酸溶液轉(zhuǎn)移到容量瓶中,最后還要用膠頭滴管定容。所以在圖示儀器中,用到的是ABD,不需要用分液漏斗,故選C。
(3) 用濃硫酸配制稀硫酸,先計(jì)算需要量取的濃硫酸的體積,然后量取所需濃硫酸,在燒杯中用適量的蒸餾水將它稀釋并冷卻至室溫,把制得的溶液小心地轉(zhuǎn)移至容量瓶中,用少量蒸餾水洗滌燒杯和玻璃棒2~3次,每次洗滌的液體都小心注入容量瓶,并輕輕振蕩,繼續(xù)向容量瓶中加蒸餾水至液面距刻度1~2cm處,改用膠頭滴管小心滴加蒸餾水至溶液凹液面底部與刻度線相切,將容量瓶塞塞緊,充分搖勻。故操作步驟的正確順序?yàn)?/span>BADCE。
(4) A.量取所需濃硫酸觀察液面時(shí)仰視,量取的濃硫酸多于13.6mL,溶質(zhì)的量偏大,導(dǎo)致所配溶液濃度偏高;
B.沒有洗滌燒杯和玻璃棒,導(dǎo)致溶質(zhì)的量偏小,所配溶液濃度偏低;
C.加蒸餾水時(shí),不慎超過了刻度線,使溶液體積偏大,所配溶液濃度偏低;
D.容量瓶使用前內(nèi)壁沾有水珠,對(duì)溶質(zhì)的物質(zhì)的量和溶液體積都沒有影響,對(duì)所配溶液濃度無影響;
E.用少量蒸餾水洗滌量取濃硫酸后的量筒,洗滌的液體注入容量瓶,使溶質(zhì)的量偏大,所配溶液濃度偏高;
故選AE。


 閱讀快車系列答案
閱讀快車系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
【題目】甲烷是一種清潔能源,下列有關(guān)說法正確的是( )
A.一定溫度下,反應(yīng)CO2(g)+4H2(g)=CH4(g)+2H2O(g)能自發(fā)進(jìn)行,該反應(yīng)的ΔH>0
B.堿性甲烷-空氣燃料電池的負(fù)極反應(yīng)為CH4-8e-+10OH-=CO![]() +7H2O
+7H2O
C.標(biāo)準(zhǔn)狀況下,5.6LCH4在空氣中完全燃燒,轉(zhuǎn)移電子的數(shù)目約為2.408×1024
D.甲烷和微生物共同作用可以實(shí)現(xiàn)城市廢水脫氮處理,反應(yīng)溫度越高,脫氮速率越快
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】向7.5mL0.03molL-1的H3PO4溶液中,逐滴加入相同濃度的NaOH溶液,溶液pH與NaOH溶液體積關(guān)系如圖所示,已知Ka1>Ka2>Ka3,下列說法錯(cuò)誤的是
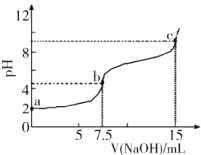
A.H3PO4第一級(jí)電離平衡常數(shù)Ka1的數(shù)量級(jí)為10-3
B.水的電離程度:b<c
C.b點(diǎn)溶液中離子濃度:c(Na+)>c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.c點(diǎn)溶液中:2c(H3PO4)+c(![]() )+c(H+)=c(OH-)+c(
)+c(H+)=c(OH-)+c(![]() )
)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】根據(jù)vt圖分析外界條件改變對(duì)可逆反應(yīng)A(g)+3B(g) ![]() 2C(g) ΔH<0的影響。該反應(yīng)的速率與時(shí)間的關(guān)系如圖所示:
2C(g) ΔH<0的影響。該反應(yīng)的速率與時(shí)間的關(guān)系如圖所示:
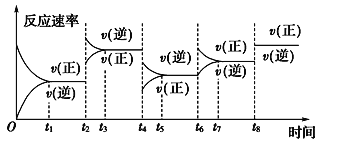
可見在t1、t3、t5、t7時(shí)反應(yīng)都達(dá)到平衡,如果t2、t4、t6、t8時(shí)都只改變了一個(gè)反應(yīng)條件,則下列對(duì)t2、t4、t6、t8時(shí)改變條件的判斷正確的是
A. 使用了催化劑、增大壓強(qiáng)、減小反應(yīng)物濃度、降低溫度
B. 升高溫度、減小壓強(qiáng)、減小反應(yīng)物濃度、使用了催化劑
C. 增大反應(yīng)物濃度、使用了催化劑、減小壓強(qiáng)、升高溫度
D. 升高溫度、減小壓強(qiáng)、增大反應(yīng)物濃度、使用了催化劑
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】X、Y、Z、M、Q、R為短周期元素,其原子半徑和最外層電子數(shù)之間的關(guān)系如圖所示。下列說法錯(cuò)誤的是
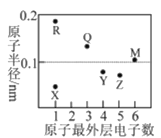
A.R不能把Q從其鹽溶液中置換出來
B.X、R、Q三種元素可以構(gòu)成離子化合物
C.熱穩(wěn)定性:ZX3<YX4
D.X2M的水溶液露置于空氣中易變質(zhì)
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】常溫下,用AgNO3溶液分別滴定濃度均為0.01mol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡圖象如圖所示(不考慮![]() 的水解,pAg=
的水解,pAg=![]() lgc(Ag+)),下列說法正確的是
lgc(Ag+)),下列說法正確的是
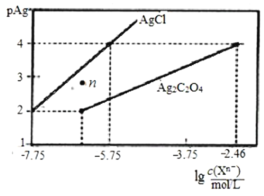
A.KspAg2C2O4的數(shù)量級(jí)等于10-10
B.n點(diǎn)表示AgCl的過飽和溶液
C.向c(Cl-)=c(![]() )的混合液中滴入AgNO3溶液時(shí),先生成Ag2C2O4沉淀
)的混合液中滴入AgNO3溶液時(shí),先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl-![]() 2AgCl+
2AgCl+![]() 的平衡常數(shù)為103.29
的平衡常數(shù)為103.29
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】麻黃素M是擬交感神經(jīng)藥。合成M的一種路線如圖所示:
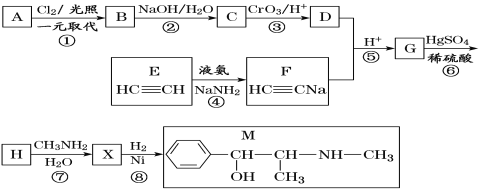
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
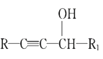
IV.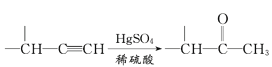
V.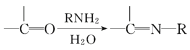
請(qǐng)回答下列問題:
(1)D的名稱是_______;G中含氧官能團(tuán)的名稱是_______。
(2)反應(yīng)②的反應(yīng)類型為_______;A的結(jié)構(gòu)簡(jiǎn)式為_______。
(3)寫出反應(yīng)⑦的化學(xué)方程式:______________________________。
(4)X分子中最多有_______個(gè)碳原子共平面。
(5)在H的同分異構(gòu)體中,同時(shí)能發(fā)生水解反應(yīng)和銀鏡反應(yīng)的芳香族化合物中,核磁共振氫譜上有4組峰,且峰面積之比為1∶1∶2∶6的有機(jī)物的結(jié)構(gòu)簡(jiǎn)式為_________________。
(6)已知:![]() 仿照上述流程,設(shè)計(jì)以苯、乙醛為主要原料合成某藥物中間體
仿照上述流程,設(shè)計(jì)以苯、乙醛為主要原料合成某藥物中間體![]() 的路線________________。
的路線________________。
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】某同學(xué)按照課本實(shí)驗(yàn)要求,用50mL0.50mol/L的鹽酸于50mL0.55mol/L的NaOH溶液在如圖所示的裝置中進(jìn)行中和反應(yīng),通過測(cè)定反應(yīng)過程中所放出的熱量計(jì)算中和熱,下列說法中,正確的是( )
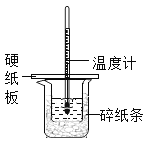
A. 燒杯間填滿碎紙條的作用是固定小燒杯
B. 用如圖裝置可以完成中和熱測(cè)定的實(shí)驗(yàn)
C. 為防止混合溶液時(shí)濺出產(chǎn)生誤差,因此混合時(shí)速度要慢
D. 若將鹽酸體積改為60mL,不考慮熱量損失,理論上所求中和熱相等
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
【題目】乙基叔丁基酸(以ETBE表示)是一種性能優(yōu)良的高辛烷值汽油調(diào)和劑,用乙醇與異丁烯(以IB表示)在催化劑HZSM-5催化下合成ETBE,反應(yīng)的化學(xué)方程式為:C2H5OH(g)+IB(g)![]() ETBE(g) △H,回答下列問題:
ETBE(g) △H,回答下列問題:
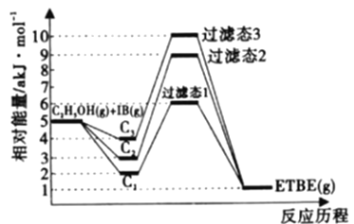
注:C1表示乙醇和異丁烯同時(shí)吸附,C2表示先吸附乙醇,C3表示先吸附異丁烯。
(1)反應(yīng)物被催化劑HZSM-5吸附的順序與反應(yīng)歷程的關(guān)系如上圖所示,該反應(yīng)的△H=____akJ·mol-1,下列選項(xiàng)正確的是______(填序號(hào))。
A.反應(yīng)歷程的最優(yōu)途徑是C1
B.HZSM-5沒有參加化學(xué)反應(yīng)
C.相同條件下,采用不同途徑時(shí),乙醇的平衡轉(zhuǎn)化率C1>C2>C3
D.升高反應(yīng)溫度有利于提高平衡產(chǎn)率
(2)向剛性容器中按物質(zhì)的量之比1:1充入乙醇和異丁烯,在溫度為378 K與388 K時(shí)異丁烯的轉(zhuǎn)化率隨時(shí)間變化如圖所示。
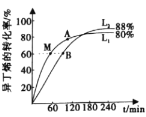
①圖中A、M、B三點(diǎn),化學(xué)反應(yīng)速率由大到小的順序?yàn)?/span>______,其中逆反應(yīng)速率最大的點(diǎn)是______(用符號(hào)A、M、B填寫)。
②388 K時(shí),容器內(nèi)起始總壓為P0 Pa,用分壓表示的該反應(yīng)的平衡常數(shù)K=______Pa-1(用含有P0的式子表示)。
③瑞典化學(xué)家阿累尼烏斯的化學(xué)反應(yīng)速率經(jīng)驗(yàn)定律為:![]() ,(其中,k為速率常數(shù),A、R為常數(shù),Ea為活化能,T為絕對(duì)溫度,e為自然對(duì)數(shù)底數(shù),約為2.718)。由此判斷下列說法中正確的是_____(填序號(hào),k正 、k逆為正、逆速率常數(shù))。
,(其中,k為速率常數(shù),A、R為常數(shù),Ea為活化能,T為絕對(duì)溫度,e為自然對(duì)數(shù)底數(shù),約為2.718)。由此判斷下列說法中正確的是_____(填序號(hào),k正 、k逆為正、逆速率常數(shù))。
A.其他條件不變,升高溫度,k正增大,k逆變小
B.其他條件不變,使用催化劑,k正、k逆同倍數(shù)增大
C.其他條件不變,増大反應(yīng)物濃度k正增大,k逆不變
D.其他條件不變,減小壓強(qiáng),k正、k逆都變小
已知反應(yīng)速率υ=υ正-υ逆=k正P(C2H5OH)·P(IB)-k逆P(ETBE),計(jì)算上圖中M點(diǎn)![]() =_______(保留兩位小數(shù))
=_______(保留兩位小數(shù))
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com