
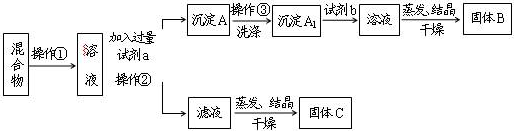
分析 分離KCl和BaCl2兩種固體混合物,可先溶于水,然后加入過量K2CO3使BaCl2轉化為沉淀,過濾后沉淀加入鹽酸可生成BaCl2溶液,經蒸發、結晶、干燥后可得固體BaCl2,操作②所得濾液為KCl和K2CO3的混合物,應加入過量鹽酸可得KCl,以此解答該題.
解答 解:分離KCl和BaCl2兩種固體混合物,可先溶于水,然后加入過量K2CO3使BaCl2轉化為沉淀,過濾后沉淀加入鹽酸可生成BaCl2溶液,經蒸發、結晶、干燥后可得固體BaCl2,操作②所得濾液為KCl和K2CO3的混合物,應加入過量鹽酸可得KCl.
(1)將固體配成溶液,應加水溶解,操作②為固體和液體的分離,為過濾操作,故答案為:溶解;過濾;
(2)固體溶解后加入過量K2CO3使BaCl2轉化為沉淀,過濾后沉淀加入鹽酸可生成BaCl2溶液,經蒸發、結晶、干燥后可得固體BaCl2,
故答案為:K2CO3;HCl;BaCl2;
(3)加入試劑a,K2CO3與BaCl2反應生成BaCO3沉淀,發生的離子方程式為CO32-+Ba2+=BaCO3↓,
加入試劑b,BaCO3沉淀加入鹽酸可生成BaCl2溶液,反應的離子方程式為BaCO3+2H+=Ba2++CO2↑+H2O,
故答案為:CO32-+Ba2+=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;
(4)濾液為KCl和K2CO3的混合物,⑥蒸發結晶前應加入適量稀鹽酸,將過量的碳酸鉀轉化成氯化鉀,故答案為:否;在應濾液中加入過量鹽酸后再蒸發結晶.
點評 本題考查物質的分離、提純操作側重于學生的分析、實驗能力的考查,題目難度不大,注意把握物質的性質,根據性質選擇反應試劑,把握化學基本實驗操作知識.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  可用于除去碳酸鈉固體中含有的少量碳酸氫鈉 | |
| B. |  可用于碳酸鈣固體和氯化鈉溶液的分離 | |
| C. |  可正確觀察鉀元素焰色反應 | |
| D. | 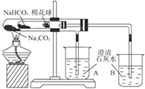 小試管中NaHCO3分解,(B)中澄清石灰水變渾濁,(A)中澄清石灰水沒渾濁,說明穩定性Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 上述反應屬于分解反應、氧化還原反應 | |
| B. | 高氯酸銨屬于鹽,該反應屬于離子反應 | |
| C. | 上述反應瞬間產生的高溫氣體是推動飛船飛行的主要因素 | |
| D. | 在反應中NH4ClO4既是氧化劑又是還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NO2-酸性氧化物 Na2O2-堿性氧化物 Al2O3-兩性氧化物 | |
| B. | 鹽酸-混合物 膽礬-純凈物 金剛石-單質 | |
| C. | 純堿-堿 硫化氫-酸 小蘇打-酸式鹽 | |
| D. | 液氯-非電解質 硫酸鋇-強電解質 醋酸-弱電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
時間(h) 物質的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L0.5mol•L-1氨水中所含NH4+數為0.5NA | |
| B. | 1molFe與足量氯氣反應轉移的電子數為2NA | |
| C. | 標準狀況下,33.6LCO2約含有1.5NA個分子 | |
| D. | 1mol 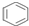 中含碳碳雙鍵數為3NA 中含碳碳雙鍵數為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com