
分析 (1)NO2和N2O4的混合氣體中O元素質量分數為$\frac{32}{46}$,計算氧元素質量,再根據n=$\frac{m}{M}$計算氧原子物質的量;
根據n=cV計算硝酸鐵物質的量,硝酸根物質的量為硝酸鐵的3倍,再根據N=nNA計算硝酸根數目;
(2)①反應中只有N元素化合價變化,由+3價升高為HNO3中+5價,降低為NO中+2價,則NO的系數為2、HNO3系數為1,NF3的系數為3,結合原子守恒配平書寫方程式;根據N元素化合價變化計算轉移電子;
②氧化劑氧化性強于氧化產物氧化性;
(3)次氯酸鈉與氨氣反應生成N2H4,反應中N元素化合價升高,NH3為還原劑,則NaClO為氧化劑,反應中還原劑與氧化劑的物質的量之比為2:1,設Cl元素在還原產物中化合價為a,則2×[(-2)-(-3)]=1×(1-a),解得a=-1,故還原生成NaCl,由元素守恒可知有水生成.
解答 解:(1)NO2和N2O4的混合氣體中O元素質量分數為$\frac{32}{46}$,氧元素質量為69g×$\frac{32}{46}$=48g,氧原子物質的量為$\frac{48g}{16g/mol}$=3mol;
溶液中硝酸鐵物質的量為2L×0.6mol/L=1.2mol,硝酸根物質的量為1.2mol×3=3.6mol,NO3-離子數目為3.6NA個,
故答案為:3;3.6;
(2)①反應中只有N元素化合價變化,由+3價升高為HNO3中+5價,降低為NO中+2價,則NO的系數為2、HNO3系數為1,NF3的系數為3,結合原子守恒,可得化學方程式為:3NF3+5H2O=2NO+HNO3+9HF,若反應中生成0.2mol HNO3,轉移的電子數目=0.2mol×2×NAmol-1=0.4NA,
故答案為:3NF3+5H2O=2NO+HNO3+9HF;0.4NA;
②3NF3+5H2O=2NO+HNO3+9HF中氧化劑為NF3,NO為還原產物,氧化性NF3>NO,4NH3+3F2=NF3+3NH4F中氧化劑為F2,氧化產物為NF3,氧化性F2>NF3>NO,
故答案為:F2>NF3>NO;
(3)次氯酸鈉與氨氣反應生成N2H4,反應中N元素化合價升高,NH3為還原劑,則NaClO為氧化劑,反應中還原劑與氧化劑的物質的量之比為2:1,設Cl元素在還原產物中化合價為a,則2×[(-2)-(-3)]=1×(1-a),解得a=-1,故還原生成NaCl,由元素守恒可知有水生成,反應方程式為:NaClO+2NH3=N2H4+NaCl+H2O,
故答案為:NaClO+2NH3=N2H4+NaCl+H2O.
點評 本題考查氧化還原反應,涉及氧化還原反應計算、配平、氧化性比較等,注意從化合價變化的角度分析氧化還原反應的有關概念和計算,注意題目給予信息的運用,難度中等.


 培優好卷單元加期末卷系列答案
培優好卷單元加期末卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | KClO3和SO3溶于水后能導電,故KClO3和SO3為電解質 | |
| B. | Na2SO3溶液中:c(H+)+c(HSO3-)+c(H2SO3)═c(OH-) | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和氣體生成 | |
| D. | 向含有AgCl固體的溶液中加入適量水使AgCl溶解又達到平衡時,在該溫度下AgCl的溶度積不變,其溶解度也不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在2L密閉容器中進行反應3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0測得n(H2O)隨反應時間(t)的變化如圖所示.下列判斷正確的是( )
在2L密閉容器中進行反應3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g)△H>0測得n(H2O)隨反應時間(t)的變化如圖所示.下列判斷正確的是( )| A. | 該反應的化學平衡常數表達式為K=c4(H2O)/c4(H2) | |
| B. | 5min時該反應的υ(正)等于9min時的υ(逆) | |
| C. | 0~5min內,υ(H2)=0.10mol/(L•min) | |
| D. | 10min時平衡發生移動可能是投入還原性鐵粉引起 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 稱為“現代有機合成之父”的伍德沃德曾組織14個國家的110位化學家,協同攻關,探索維生素B12的結構,其結構如圖對此結構的下列說法中,正確的是( )
稱為“現代有機合成之父”的伍德沃德曾組織14個國家的110位化學家,協同攻關,探索維生素B12的結構,其結構如圖對此結構的下列說法中,正確的是( )| A. | 維生素B12屬于有機物 | B. | 維生素B12屬于無機物 | ||
| C. | 維生素B12屬于烴 | D. | 維生素B12屬于芳香族化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | X分子中最多可有9個碳原子共平面 | |
| B. | X可以發生取代、加成、聚合等反應 | |
| C. | 1 mol X與足量NaHCO3溶液反應所得物質的分子式為C9H7O4Na | |
| D. | 苯環上的取代基與X完全相同的X的同分異構體有4種 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗序號 | 甲 | 乙 | 丙 |
| 合金質量/mg | 255 | 385 | 459 |
| 生成氣體體積/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe的質量為2.7g,Al的質量為2.8g | B. | Fe的質量為2.8g,Al的質量為2.7g | ||
| C. | Fe的質量為5.4g,Al的質量為5.6g | D. | Fe的質量為5.6g,Al的質量為5.4g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
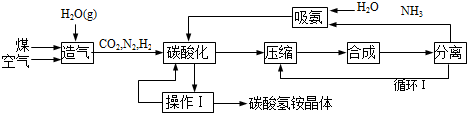

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖所示,是原電池的裝置圖,請回答:
如圖所示,是原電池的裝置圖,請回答:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com