
分析 (1)在水溶液中能完全電離的化合物為強電解質,包括強酸、強堿和絕多數的鹽;在水溶液中不能完全電離的化合物為弱電解質,包括弱酸、弱堿、少部分鹽和水,據此分析;
(2)根據抗酸藥物有效成分能中和胃里過多的鹽酸分析;
(3)根據得失電子數守恒來分析計算;
(4)在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反應中,Mn元素化合價降低,被還原,Cl元素化合價升高,被氧化,KMnO4為氧化劑,HCl為還原劑,據此分析.
解答 解:(1)在水溶液中能完全電離的化合物為強電解質,包括強酸、強堿和絕多數的鹽,故①硫酸 ④硫酸鋇 ⑧氯化氫⑫NaHCO3屬于強電解質;在水溶液中不能完全電離的化合物為弱電解質,包括弱酸、弱堿、少部分鹽和水,故 ⑦醋酸 為弱電解質,故答案為:①④⑧⑫;⑦;
(2)碳酸氫鈉和氫氧化鋁都能中和胃里過多的鹽酸.碳酸氫鈉和鹽酸反應生成氯化鈉、水和二氧化碳,反應的離子方程式為:HCO3-+H+=CO2↑+H2O;氫氧化鋁和鹽酸反應生成氯化鋁和水,反應的離子方程式為:Al(OH)3+3H+═Al3++3H2O,
故答案為:HCO3-+H+=CO2↑+H2O;Al(OH)3+3H+═Al3++3H2O;
(3)1mol二氧化錳得2mol電子,而當生成1mol氯氣時失去2mol電子,故根據得失電子數守恒可知,二氧化錳的計量數為1,氯氣的計量數也為1,根據質量守恒可知,氯化錳的計量數也為1,則HCl的計量數為4,故水的計量數為2,此反應轉移2mol電子,故電子轉移情況為 ,故答案為:
,故答案為: ;
;
(4)在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反應中,Mn元素化合價降低,被還原,Cl元素化合價升高,被氧化,KMnO4為氧化劑,HCl為還原劑,Cl2為氧化產物,MnCl2為還原產物,當有2molKMnO4參加反應時,有10molHCl被氧化,則氧化劑與還原劑的物質的量之比為1:5,故答案為:1:5.
點評 本題考查了得失電子數的分析和用雙線橋標示電子的得失,并考查了強弱電解質的區別,應注意的是強弱電解質的本質區別是能否完全電離.


科目:高中化學 來源: 題型:選擇題
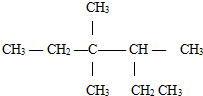
| A. | 3,3-二甲基-2-乙基戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 3,3,4-三甲基己烷 | D. | 3,4,4-三甲基己烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液的質量仍然相等 | B. | 溶質的質量仍然相等 | ||
| C. | 溶劑的質量仍然相等 | D. | 溶液的密度仍然相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
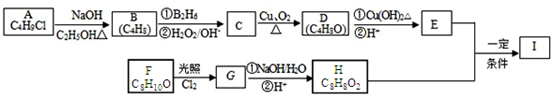

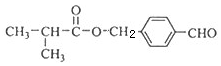 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 屬于溶液 | B. | 能產生丁達爾效應 | ||
| C. | 分散質粒子能透過濾紙 | D. | 納米碳粒子能夠發生布朗運動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原電池的正極和電解池的陽極都是發生氧化反應 | |
| B. | 用鉑做電極電解NaOH溶液時,溶質的質量不變,但濃度卻隨著電解的進行而增大 | |
| C. | 電解食鹽水時,由于OH-離子向陽極移動,所以加酚酞時陽極附近可變紅色 | |
| D. | 電解食鹽水時,陰極區溶液里H+離子的濃度相對增大,使酚酞試液不變色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤⑥ | B. | ③④⑤⑥ | C. | ②④⑤⑥ | D. | ①③④⑥ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com