
 .
.| 選項 | 陳述Ⅰ | 陳述Ⅱ | 判斷 |
| A | 鐵是地殼中含量最高的金屬元素 | 鐵是人類最早使用的金屬材料 | Ⅰ對;Ⅱ對. |
| B | 鋁箔在酒精燈火焰上加熱融化但不滴落 | 鋁箔對熔化的鋁有較強的吸附作用 | Ⅰ對;Ⅱ錯. |
| C | 鋁粉可以和氧化鐵粉末發生鋁熱反應 | 鋁熱反應是工業煉鐵最常用方法 | Ⅰ對;Ⅱ錯. |
| D | 銅在潮濕空氣中表面會生成銅綠 | 可用銅容器盛放濃硫酸 | Ⅰ對;Ⅱ對. |
分析 (1)鋁原子結構中有3個電子層,最外層電子數為3,離子核外有10個電子;
(2)金屬越活潑,對應陽離子的氧化性越弱,FeCl3溶液與銅反應生成氯化亞鐵和氯化銅;
(3)硫酸鐵可用作絮凝劑的原理為三價鐵離子水解生成氫氧化鐵的膠體具有吸附性,但在酸性廢水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3膠體;
(4)A.地殼中含量最高的金屬元素是鋁,人類最早使用的金屬材料是銅;
B.氧化鋁的熔點高;
C.鋁熱反應為放熱反應,可用來冶煉熔點高的金屬;
D.Cu性質不活潑,常溫下與濃硫酸不反應;
(5)合金溶于過量鹽酸鐵和鋁反應,剩余固體質量為硅的質量,計算得到n(Si),加入過量氫氧化鈉溶液鋁離子反應全部變化為偏鋁酸鈉,鐵離子生成氫氧化鐵過濾、洗滌得固體.再將所得固體充分加熱、灼燒,得紅棕色粉末1.60g為Fe2O3,計算得到鐵元素物質的量,結合質量守恒計算合金中鋁元素物質的量得到化學式.
解答 解:(1)鋁的原子結構示意圖為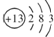 ,Al位于周期表中第三周期第ⅢA族,鋁離子核內有13個質子,核外有10個電子,則鋁離子的結構示意圖為
,Al位于周期表中第三周期第ⅢA族,鋁離子核內有13個質子,核外有10個電子,則鋁離子的結構示意圖為 ,
,
故答案為:第三周期第ⅢA族; ;
;
(2)FeCl3溶液可以蝕刻銅箔,因為鐵離子具有氧化性,將銅單質氧化生成銅離子和亞鐵離子,反應的離子方程式為2Fe3++Cu═2Fe2++Cu2+,則氧化性為Fe3+>Cu2+,金屬越活潑,對應陽離子的氧化性越弱,可知氧化性為Cu2+>Al3+,則Fe3+、Al3+、Cu2+三種金屬陽離子氧化性有強到弱的排列順序是Fe3+>Cu2+>Al3+,
故答案為:Fe3+>Cu2+>Al3+;2Fe3++Cu=2Fe2++Cu2+;
(3)硫酸鐵可用作絮凝劑的原理為三價鐵離子水解生成氫氧化鐵的膠體具有吸附性,但在酸性廢水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3膠體,
故答案為:Fe3++3H2O?Fe(OH)3(膠體)+3H+,酸性廢水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3膠體;
(4)A.地殼中含量最高的金屬元素是鋁,人類最早使用的金屬材料是銅,判斷均不合理,故A錯誤;
B.氧化鋁的熔點高,包裹在鋁的外面,則鋁箔在酒精燈火焰上加熱融化但不滴落,判斷合理,故B正確;
C.鋁熱反應為放熱反應,可用來冶煉熔點高的金屬,工業煉鐵為高爐煉鐵,利用熱還原法,判斷合理,故C正確;
D.Cu性質不活潑,常溫下與濃硫酸不反應,但不用銅容器盛放濃硫酸,一般利用Fe、Al容器盛放濃硫酸,故D錯誤;
故答案為:BC;
(5)1.46g該合金粉末,加入過量鹽酸溶液,充分反應后過濾,鐵和鋁全部溶解,測定剩余固體質量0.07g為硅.n(Si)=$\frac{0.07g}{28g/mol}$=0.0025mol,向濾液中滴加足量NaOH濃溶液,鋁離子反應生成偏鋁酸鈉,充分攪拌、過濾、洗滌得固體.判斷為Fe(OH)3,再將所得固體充分加熱、灼燒,得紅棕色粉末1.60g為Fe2O3,鐵的物質的量n(Fe)=$\frac{1.60g}{160g/mol}$×2=0.02mol,n(Al)=$\frac{1.46g-0.07g-0.02mol×56g/mol}{27g/mol}$=0.01mol;n(Fe):n(Al):n(Si)=0.02:0.01:0.0025=8:4:1,即化學式為Fe8Al4Si,故答案為:Fe8Al4Si.
點評 本題考查較綜合,涉及金屬及化合物的性質、鹽類水解、氧化還原反應、物質組成的確定等,綜合性較強,把握相關反應原理為解答的關鍵,側重分析與應用能力的綜合考查,題目難度中等.


 世紀百通期末金卷系列答案
世紀百通期末金卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 4.5mol•L-1 | B. | 5mol•L-1 | C. | 6mol•L-1 | D. | 8mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 為提高農作物的產量和質量,應大量使用化肥和農藥 | |
| B. | 油脂和汽油都屬于酯類,都能用作工業制肥皂 | |
| C. | 純堿可用于生成普通玻璃,日常生活中也可能用初年溶液來除去物品表面的油污 | |
| D. | 霧霾嚴重影響了人們的正常生活,為改善空氣質量,可以加高工廠的煙囪,使灰塵和廢氣遠離地表 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .W、X、Y的離子半徑由大到小的順序為S2->O2->Al3+(用離子符號回答)
.W、X、Y的離子半徑由大到小的順序為S2->O2->Al3+(用離子符號回答)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硅是半導體材料,可用于制備光導纖維 | |
| B. | Na2O2能與CO2反應,可用作呼吸面具的供氧劑 | |
| C. | 明礬能水解生成Al(OH)3膠體,可用作凈水劑 | |
| D. | Al2O3熔點高,可用于制作耐高溫儀器 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 吸入氯氣、氯化氫氣體時,可吸入少量酒精或乙醚的混合蒸氣解毒 | |
| B. | 移液管放液時,將移液管稍傾斜放入直立的容器中,并使管尖與容器內壁接觸,松開食指使溶液全部流出,數秒后,取出移液管 | |
| C. | 生物體死亡后,體內含有的碳-14會逐漸減少,因此可通過測量生物體遺骸中碳-14的含量,來計算它存活的年代.碳-14減少的變化為化學變化 | |
| D. | 當用電解法除去溶液中的Cr2O72-離子時,因其具有強氧化性易得電子,故可在陰極直接放電生成Cr3+,最后生成Cr(OH)3沉淀除去 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com