
短周期主族元素X、Y、Z、W、Q的原子序數依次增大。X的氣態氫化物極易溶于Y的氫化物中,常溫下,Z的塊狀單質能溶于W的最高價氧化物的水化物的稀溶液,卻不溶于其濃溶液。下列說法正確的是
A.元素Y的最高正化合價為+6
B.離子半徑的大小順序為W>Q>Z>X>Y
C.氣態氫化物的沸點:Y>W
D.元素W的最高價氧化物對應的水化物酸性比Q的強
C
【解析】
試題分析:根據題意可知:X是N;Y是O;Z是Al;W是S;Q是Cl。A.由于O元素的原子半徑小,獲得電子的能力強,所以元素Y的最高正化合價不等于原子的最外層電子數,錯誤;B.對于電子層結構不同的元素來說,元素離子的核外電子層數越多,離子半徑就越大;對于電子層結構相同的元素來說,核電荷數越大,離子半徑就越小。所以離子半徑的大小順序為W>Q >X>Y >Z,錯誤;C.元素的非金屬性越強,去氣態氫化物的穩定性就越強,由于元素的非金屬性Y>W,所以氣態氫化物的沸點:Y>W,正確;D.元素的非金屬性越強,其對應的最高價氧化物對應的水化物的酸性就越強。元素的非金屬性Q>W,所以元素Q的最高價氧化物對應的水化物酸性比W的強,錯誤。
考點:考查元素周期表、元素周期律的知識。


科目:高中化學 來源:2015屆江西省高三上學期第一次考試化學試卷(解析版) 題型:計算題
(9分)(1)在標準狀況下,將224 L HCl氣體溶于635 mL水中,所得鹽酸的密度為
1.18 g·cm-3。試計算:
①所得鹽酸物質的量濃度是 。
②取出這種鹽酸10 mL,稀釋至118 mL,所得稀鹽酸的物質的量濃度是 。如取10 mL鹽酸時仰視其他操作均正確得稀鹽酸濃度 。(填“偏大”、 “等于”、“偏小”)
③在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐漸加入(2)所稀釋的稀鹽酸,邊加邊振蕩。若使反應不產生CO2氣體,加入稀鹽酸的體積最多不超過 mL。
(2)配制0.80 mol·L-1 NaOH溶液475 mL,回答下列問題:
①根據計算用托盤天平稱取NaOH的質量為__________g。在實驗中其他操作均正確,若容量瓶用蒸餾水洗滌后未干燥,則所得溶液濃度_______0.80 mol·L-1(填“大于”、“等于”或“小于”,下同)。若還未等溶液冷卻就定容了,則所得溶液濃度__________0.80 mol·L-1。
②0.80 mol·L-1 NaOH溶液質量分數 3.2%,和等質量的水混合溶液濃度 0.40 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2015屆江西五校高三第一次聯考化學試卷(解析版) 題型:填空題
(9分)A、B、C、D、E為原子序數依次增大的短周期元素。已知A、B、E三原子最外層共有11個電子,且這三種元素的最高價氧化物對應的水化物之間兩兩皆能反應生成鹽和水;C元素的最外層電子數比次外層電子數少4,D元素原子次外層電子數比最外層電子數多3。請回答下列問題:
(1)寫出下列元素符號:A________,C________,E________。
(2) E元素+1價含氧酸的電子式為:_________________。
(3)寫出A、B兩元素最高價氧化物對應的水化物相互反應的離子方程式______________。
(4)比較C、D最高價氧化物對應水化物的酸性__________________。
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省蘇州市高三9月學情調研化學試卷(解析版) 題型:填空題
(12分)已知:硫酸銅溶液中滴入氨基乙酸鈉(H2N-CH2-COONa)即可得到配合物A。其結構如下圖:
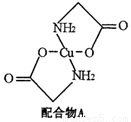
(1)Cu元素基態原子的外圍電子排布式為。
(2)元素C、N、O的第一電離能由大到小排列順序為。
(3)配合物A中碳原子的軌道雜化類型為。
(4)1mol氨基乙酸鈉(H2N-CH2-COONa)含有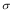 鍵的數目為。
鍵的數目為。
(5)氨基乙酸鈉分解產物之一為二氧化碳。寫出二氧化碳的一種等電子體:(寫化學式)。
(6)已知:硫酸銅灼燒可以生成一種紅色晶體,其結構如圖,
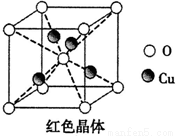
則該化合物的化學式是。
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省蘇州市高三9月學情調研化學試卷(解析版) 題型:選擇題
25℃時,下列有關溶液中微粒的物質的量濃度關系不正確的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.pH =11的氨水和pH=3的鹽酸溶液等體積混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+)
C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) = 0.1 mol·L-1
D.0.1 mol·L-1的醋酸鈉溶液20 mL與0.1 mol·L-1鹽酸10 mL混合后溶液顯酸性: c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省蘇州市高三9月學情調研化學試卷(解析版) 題型:選擇題
下列物質性質與應用對應關系正確的是
A.漂白粉在空氣中不穩定,可用于漂白紙張
B.醫用酒精能使蛋白質變性,可用于消毒殺菌
C.二氧化硅不與強酸反應,可用石英器皿盛放氫氟酸
D.銅的金屬活潑性比鐵的弱,可在鐵閘上裝若干銅塊以減緩其腐蝕
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省淮安市協作體高二下學期期中考試化學試卷(解析版) 題型:填空題
在稀氨水中存在下述電離平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分別加入少量下列物質,溶液中c(OH-)如何變化?(填“增大”“減小”或“不變”);平衡移動方向如何?(填“正向”“逆向”或“不移動”)
NH4++OH-,分別加入少量下列物質,溶液中c(OH-)如何變化?(填“增大”“減小”或“不變”);平衡移動方向如何?(填“正向”“逆向”或“不移動”)
加入的物質 | 少量(NH4)2SO4固體 | 少量HNO3溶液 | 少量KOH溶液 |
c(OH-)的變化 |
|
|
|
平衡移動方向 |
|
|
|
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省淮安市協作體高二下學期期中考試化學試卷(解析版) 題型:選擇題
一種海水電池的反應原理可表示為:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有關該反應的說法正確的是
A.反應中MnO2是還原劑
B.Ag的還原性比Na2Mn5O10強
C.該反應中MnO2具有催化作用
D.每生成1 mol Na2Mn5O10轉移1 mol電子
查看答案和解析>>
科目:高中化學 來源:2015屆江蘇省無錫江陰市高二下學期期中考試化學試卷(解析版) 題型:選擇題
2013年6月11日我國成功發射了“神州十號”。這標志著中國人的太空時代又前進了一大步。發射“神十”時用肼(N2H4)作為火箭發動機的燃料,NO2為氧化劑,反應生成N2和水蒸氣。已知:
N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ/mol
下列關于肼和NO2反應的熱化學方程式中,正確的是
A.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7 kJ/mol
B.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3 kJ/mol
C.N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7 kJ/mol
D.2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com