
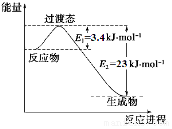
 研究表明豐富的CO2完全可以作為新碳源,解決當前應用最廣泛的碳源(石油和天然氣)到本世紀中葉將枯竭的危機,同時又可緩解由CO2累積所產生的溫室效應,實現CO2的良性循環.
研究表明豐富的CO2完全可以作為新碳源,解決當前應用最廣泛的碳源(石油和天然氣)到本世紀中葉將枯竭的危機,同時又可緩解由CO2累積所產生的溫室效應,實現CO2的良性循環.| 實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衡所需 時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
分析 (1)①發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),根據圖1可知,0.5mol CO2和1.5mol H2轉化率達80%時放熱23kJ-3.4kJ=19.6kJ,計算1mol二氧化碳發生放出的熱量確定△H,書寫該反應的熱化學方程式;
②當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,注意選擇判斷的物理量,應隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態;
(2)①依據圖表數據列式計算平衡濃度,再根據平衡常數等于生成物的濃度冪之積除以反應物的濃度冪之積進行計算;
②在反應中當反應物的物質的量之比等于化學計量數之比時,各反應物的轉化率相等,某一種反應物越多,其轉化率越低,而另一種反應物的轉化率則越高,據此答題;
③根據濃度商Qc與平衡常數K的大小,判斷反應進行的方向,進而確定正逆反應的速率的大小關系;
(3)依據蓋斯定律進行計算,由$\frac{①-②+③×4}{2}$得出正確結論;
(4)H2C2O4和NaOH反應生成NaHC2O4,NaHC2O4溶液呈酸性說明溶液中電離大于水解,依此比較溶液中HC2O4-、C2O42-、H2C2O4、H+的濃度從大到小的順序;
(5)原電池負極發生氧化反應,甲醚在負極放電,堿性條件下生成碳酸根與水,依此書寫電極反應式.
解答 解:(1)①根據圖1可知,0.5mol CO2和1.5mol H2轉化率達80%時放熱23kJ-3.4kJ=19.6kJ,1mol二氧化碳反應放出的熱量為$\frac{1mol}{0.5mol×80%}$×19.6kJ=49kJ,則該反應的熱化學方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49kJ•mol-1,
故答案為:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49 kJ•mol-1;
②a.反應再恒壓容器中進行,故容器中壓強不變,不能說明反應達到平衡狀態,故a錯誤;
b.H2的體積分數不變,說明反應達到平衡狀態,故b正確;
c.平衡時各物質的濃度之比取決于物質的起始物質的量和轉化率,故c(H2)=3c(CH3OH),不能說明反應達到平衡狀態,故c錯誤;
d.密度ρ=$\frac{m}{V}$,總質量會變,體積會變,故容器中密度不變,說明反應達到平衡狀態,故d正確;
e.2個C=O斷裂是正反應,同時有6個H-H斷裂也是正反應,故不能說明反應達到平衡狀態,故e錯誤;
故答案為:bd;
(2)①H2O(g)+CO(g)?CO2(g)+H2(g)
初始濃度 0.5mol/L 1mol/L 0 0
轉化濃度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡濃度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.2×0.2}{0.3×0.8}$=0.17,
故答案為:0.17;
②在反應中當反應物的物質的量之比等于化學計量數之比時,各反應物的轉化率相等,某一種反應物越多,其轉化率越低,而另一種反應物的轉化率則越高,所以要使CO的轉化率大于水蒸氣,則0<$\frac{a}{b}$<1,
故答案為:0<$\frac{a}{b}$<1;
③900℃時,當CO、H2O、CO2、H2均為1mol時,濃度商Qc=$\frac{0.5×0.5}{0.5×0.5}$=1>0.17=K,所以此時平衡要逆向移動,故V正<V逆,
故答案為:<;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
由$\frac{①-②+③×4}{2}$得:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=$\frac{-1275.6kJ/mol-(-566.0kJ/mol)+(-44.0kJ/mol)×4}{2}$=-442.8KJ/mol;
故答案為:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJ/mol;
(4)常溫下,向10mL 0.01mol•L-1 H2C2O4溶液中滴加10mL 0.01mol•L-1NaOH溶液時,H2C2O4和NaOH反應生成NaHC2O4,由于NaHC2O4溶液顯酸性,故溶液中HC2O4-的電離程度大于其水解程度,所以c(C2O42-)>c(H2C2O4),由于氫離子來自水的電離和HC2O4-的電離,則c(H+)>c(C2O42-),HC2O4-的水解程度較小,則c(HC2O4-)>c(C2O42-),所以溶液中各離子濃度大小為c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案為:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)原電池負極發生氧化反應,甲醚在負極放電,堿性條件下生成碳酸根與水,電極反應式為:CH3OCH3+16OH--12e-=2CO32-+11H2O,
故答案為:CH3OCH3+16OH--12e-=2CO32-+11H2O.
點評 本題為綜合題,考查熱化學方程式的書寫、化學平衡狀態判斷的標志、平衡常數的計算及化學平衡移動原理、蓋斯定律的計算應用、離子濃度大小的比較、電解池反應原理及電極反應式的書寫,明確化學平衡相關理論,熟悉蓋斯定律計算反應熱的方法,原電池工作原理是解題關鍵,題目難度中等.


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:實驗題
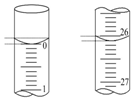 某學生用0.100 0mol/L的NaOH標準溶液滴定未知濃度的鹽酸,其操作可分為如下幾步:
某學生用0.100 0mol/L的NaOH標準溶液滴定未知濃度的鹽酸,其操作可分為如下幾步:| 滴定 次數 | 鹽酸溶液/mL | 0.100 0mol•L-1NaOH的體積(mL) | ||
| 滴定前 | 滴定 | 溶液體積/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | ①Ⅰ | B. | ②Ⅱ | C. | ③Ⅲ | D. | ④Ⅱ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


 .
. .
. 有多種同分異構體,其中含有1個醛基和2個羥基的芳香族化合物共有
有多種同分異構體,其中含有1個醛基和2個羥基的芳香族化合物共有 最合理的方案.
最合理的方案.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入幾滴硫酸銅溶液 | B. | 加入適量的水 | ||
| C. | 加入適量NaCl溶液 | D. | 再加入少量稀硫酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 +6SO2,則
+6SO2,則 中的化學式為Fe3O4,反應中化合價升高的元素有鐵、硫.
中的化學式為Fe3O4,反應中化合價升高的元素有鐵、硫.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫原子的原子結構示意圖: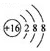 | |
| B. | 原子核內有10個質子的氧原子${\;}_{8}^{18}$O | |
| C. | NH4Cl的電子式: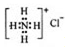 | |
| D. | 鄰氯甲苯的結構簡式: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室蒸餾石油時,蒸餾燒瓶中加入一些碎瓷片,為防止暴沸,冷凝管下口進冷水上口出熱水 | |
| B. | 實驗室制備硝基苯時,將硝酸與苯混合后再滴加濃硫酸 | |
| C. | 實驗使手指不小心沾上苯酚,立即用70℃以上的熱水清洗 | |
| D. | 檢驗蔗糖是否水解:蔗糖溶液在稀硫酸存在下水浴加熱一點時間后,再與銀氨溶液混合加熱,觀察現象 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com