
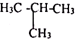 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷. 分析 (1)周期序數等于電子層數,最外層電子數等于主族序數,由此分析解答;
(2)離子晶體的熔沸點大于分子晶體;中心元素非金屬性越強對應氫化物越穩定;
(3)短周期中,最高價氧化物對應的水化物堿性最強的物質,是金屬性最強的鈉,所以是堿性最強的是氫氧化鈉;
(4)同分異構體是指分子式相同,但結構不同的化合物,同分異構體包含碳鏈異構、官能團異構、位置異構等,以此來解答.
解答 解:(1)因為元素X的原子有3個電子層,所以第三周期,最外層有4個電子,所以是第ⅣA族,即第三周期ⅣA族,故答案為:第三周期ⅣA族;
(2)離子晶體的熔沸點大于分子晶體,氮化鈉是離子晶體,而碘單質是分子晶體,所以熔點:氮化鈉>碘單質;中心元素非金屬性越強對應氫化物越穩定,非金屬性:N>P,所以穩定性:PH3<NH3,故答案為:>;<;
(3)短周期中,最高價氧化物對應的水化物堿性最強的物質,是金屬性最強的鈉,所以是堿性最強的是氫氧化鈉,故答案為:NaOH;
(4)A、紅磷和白磷是同素異形體,故不選; B、CH3CH2CH2CH3 和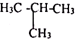 ,兩都分子式相同,但結構不同,是同分異構體,故選;
,兩都分子式相同,但結構不同,是同分異構體,故選;
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C,質子數相同,而中子數不同的原子,互稱同位素,故不選; D、甲烷和丙烷,是同系物,故不選;
故選B.
點評 本題考查了元素在同期表中的位置、氫化物的穩定性和同分異構體的判斷、有機物的結構,難度不大,注意對同分異構體定義的理解,注意同分異構體、同素異形體、同系物、同位素的區別.


 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案 新黃岡兵法密卷系列答案
新黃岡兵法密卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 物質的量濃度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三種溶液,c(NH4+)的大小順序為:①>②>③ | |
| B. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| C. | 向0.2mol•L-1NaHCO3溶液中加入等體積0.1mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 0.2mol•L-1HCl與0.1mol•L-1NaAlO2溶液等體積混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | 鍵能/(kJ•mol-1) | 化學鍵 | 鍵能/(kJ•mol-1) |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A. | 氫氣的燃燒熱為△H=-483kJ/mol | |
| B. | H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=-5kJ/mol | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol | |
| D. | 在相同條件下,等量的氫氣完全燃燒和與氧氣組成燃燒電池時,焓變相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,請回答以下問題:
,請回答以下問題:
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

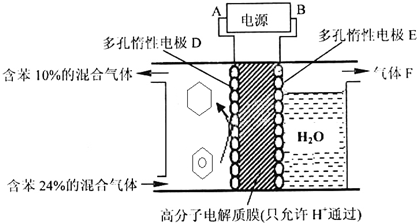
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “類鈁”對于的氫氧化物不溶于水 | B. | “類鈁”不能再空氣中穩定存在 | ||
| C. | “類鈁”單質不與水反應 | D. | “類鈁”單質有較高的熔點 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 流程中的反應全部都是非氧化還原反應 | |
| B. | M是鹽酸 | |
| C. | 電解熔融MgO比電解熔融MgCl2制金屬鎂更節約能量 | |
| D. | 操作b只是過濾 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 離子組 | 加入試劑 | 加入試劑后發生反應的離子方程式 |
| A | Fe2+、NO3-、NH4+ | NaHSO4溶液 | 3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO3-、Cl- | 少量NaOH溶液 | Ca2++2HCO3-+2OH-═2H2O+CaCO3↓+CO32- |
| C | K+、AlO2-、HCO3- | 通入少量CO2 | 2AlO2-+3H2O+CO2═2Al(0H)3↓+CO32- |
| D | NH4+、Al3+、SO42- | 少量Ba(OH)2 溶液 | 2 NH4++2SO42-+Ba2++2OH═BaSO42-+2NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com