
 二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑,回答下列問題:
二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑,回答下列問題: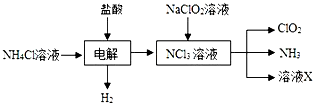
分析 (1)KClO3在H2SO4存在下與Na2SO3反應,SO32-被氧化成SO42-,由電子、電荷守恒可知該離子反應為2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O;
(2)由生產流程可知氯化銨在鹽酸溶液中進行電解,陰極生成氫氣,陽極生成NCl3,電解方程式為NH4Cl+2HCl$\frac{\underline{\;通電\;}}{\;}$NCl3+3H2↑,在NCl3溶液中加入NaClO2,可生成ClO2、NH3和X,X中含Cl-、OH-,
①由生產流程可知氯化銨在鹽酸溶液中進行電解,陰極生成氫氣,陽極生成NCl3,電解方程式為NH4Cl+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$NCl3+3H2↑;
②由信息可知,ClO2易溶于水,所以不能利用水溶液吸收,氨氣為堿性氣體,利用性質差異分離提純;
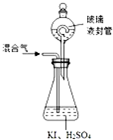
(3)①由題目信息可知,ClO2通入錐形瓶與酸性碘化鉀溶液反應,氧化I-為I2,自身被還原為Cl-,同時生成水;
②玻璃液淀粉遇碘單質變藍;
③封裝置可防止有害氣體逸出;
④根據關系式2ClO2~5I2~10Na2S2O3計算n(ClO2),再根據m=nM計算m(ClO2);
(4)亞氯酸鹽具有氧化性,Fe2+將ClO2-還原成Cl-,Fe2+ 被氧化為鐵離子.
解答 解:(1)KClO3在H2SO4存在下與Na2SO3反應制得ClO2,可知SO32-被氧化成SO42-,由電子、電荷守恒可知該離子反應為2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化劑為KClO3,還原劑為Na2SO3,由離子反應可知該反應氧化劑與還原劑物質的量之比為2:1,
故答案為:2:1;
(2)①由生產流程可知氯化銨在鹽酸溶液中電解,陰極生成氫氣,陽極生成NCl3,電解方程式為NH4Cl+2HCl$\frac{\underline{\;通電\;}}{\;}$NCl3+3H2↑,
故答案為:NH4Cl+2HCl$\frac{\underline{\;通電\;}}{\;}$NCl3+3H2↑;
②a.ClO2易溶于水,不能利用水吸收氨,故a錯誤;
b.堿石灰不能吸收氨氣,故b錯誤;
c.濃硫酸可以吸收氨氣,且不影響ClO2,故c正確;
d.ClO2易溶于水,不能利用飽和食鹽水吸收氨氣,故d錯誤;
故答案為:c;
(3)①由題目信息可知,ClO2通入錐形瓶與酸性碘化鉀溶液反應,氧化I-為I2,自身被還原為Cl-,同時生成水,反應離子方程式為2ClO2+10I-+8H+═2Cl-+5I2+4H2O,
故答案為:2ClO2+10I-+8H+═2Cl-+5I2+4H2O;
②玻璃液封裝置的作用是吸收殘留的ClO2氣體避免碘的逸出,
故答案為:吸收殘留的ClO2氣體;
③V中加入的指示劑通常為淀粉溶液,滴定至終點的現象是溶液由藍色變為無色,且半分鐘內不變色,
故答案為:溶液由藍色變為無色,且半分鐘內不變色;
④含有Na2S2O3物質的量為0.02 L×0.1mol/L=0.002 mol,則:
根據關系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) 0.002mol
所以n(ClO2)=0.0004mol,
所以m(ClO2)=0.004 mol×67.5g/mol=0.02700g,
故答案為:0.02700;
(4)若要除去超標的亞氯酸鹽,AD均不能還原亞氯酸鹽,B中KI具有還原性但氧化產物不適合飲用水使用,只有C中Fe2+將ClO2-還原成Cl-,Fe2+ 被氧化為鐵離子,且鐵離子水解生成膠體可凈化飲用水,則最適宜的是D,
故答案為:D.
點評 本題考查物質含量的測定,為高頻考點,把握物質的性質、制備流程、發生的反應為解答的關鍵,側重分析與實驗、計算能力的綜合考查,綜合性較強,題目難度中等.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 物質 | SiC14 | A1C13 | FeC13 |
| 沸點/℃ | 57.7 | - | 315 |
| 熔點/℃ | -70.0 | - | - |
| 升華溫度/℃ | - | 180 | 300 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
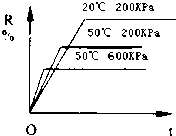 在密閉容器中進行下列反應:M(氣)+N(氣)?R(氣)+2L(?),該反應中R的百分含量在不同條件下的變化如下圖所示,請判斷下列結論正確的是( )
在密閉容器中進行下列反應:M(氣)+N(氣)?R(氣)+2L(?),該反應中R的百分含量在不同條件下的變化如下圖所示,請判斷下列結論正確的是( )| A. | 正反應為放熱反應,L為氣體 | B. | 正反應為吸熱反應,L為氣體 | ||
| C. | 正反應為吸熱反應,L為固體或液體 | D. | 正反應為放熱反應,L為固體或液體 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
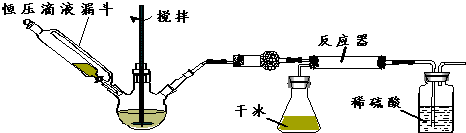
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 由圖Ⅰ可知,加入適當的催化劑,E和△H都減小 | |
| B. | 圖Ⅱ中0~10 min內該反應的平均速率v(Y2)=0.045 mol•L-1•min-1,從11 min起其他條件不變,壓縮容器的體積為1 L,則n(X2)的變化曲線為d | |
| C. | 圖Ⅲ中a、b、c三點所處的平衡狀態中,反應物X2的轉化率最高的是b點 | |
| D. | 圖Ⅲ中T1和T2表示溫度,對應溫度下的平衡常數為K1、K2,則T1<T2,K1<K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
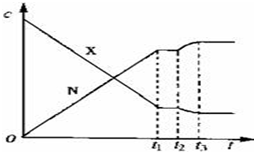
| A. | 降低溫度 | B. | 增大N的濃度 | C. | 減小X的濃度 | D. | 增大壓強 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com