
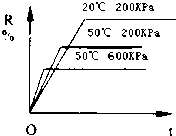
 在密閉容器中進行下列反應:M(氣)+N(氣)?R(氣)+2L(?),該反應中R的百分含量在不同條件下的變化如下圖所示,請判斷下列結論正確的是( )
在密閉容器中進行下列反應:M(氣)+N(氣)?R(氣)+2L(?),該反應中R的百分含量在不同條件下的變化如下圖所示,請判斷下列結論正確的是( )| A. | 正反應為放熱反應,L為氣體 | B. | 正反應為吸熱反應,L為氣體 | ||
| C. | 正反應為吸熱反應,L為固體或液體 | D. | 正反應為放熱反應,L為固體或液體 |
 培優三好生系列答案
培優三好生系列答案 優化作業上海科技文獻出版社系列答案
優化作業上海科技文獻出版社系列答案科目:高中化學 來源: 題型:選擇題
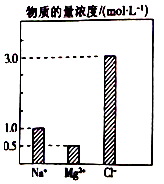 在0.2L由NaCl、MgCl2、BaCl2組成的混合溶液中,部分離子濃度大小如圖所示,對于該溶液成分,下列說法不正確的是( )
在0.2L由NaCl、MgCl2、BaCl2組成的混合溶液中,部分離子濃度大小如圖所示,對于該溶液成分,下列說法不正確的是( )| A. | NaCl的物質的量為0.2mol | |
| B. | 溶質MgCl2的質量為9 g | |
| C. | 該混合液中BaCl2的物質的量為0.1mol | |
| D. | 將該混合液加水稀釋至體積為1 L,稀釋后溶液中的Ba2+物質的量濃度為0.1mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
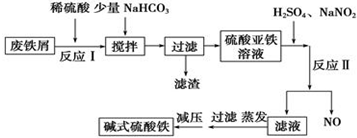
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 開始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
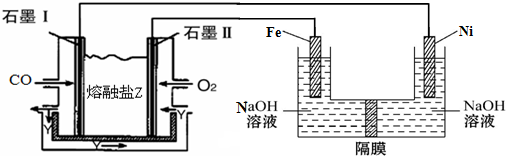
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)=2H2O(l)△H=+484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g)△H=-484kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
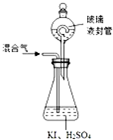 二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑,回答下列問題:
二氧化氯(ClO2,黃綠色易溶于水的氣體)是高效、低毒的消毒劑,回答下列問題: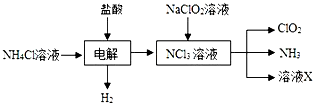
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
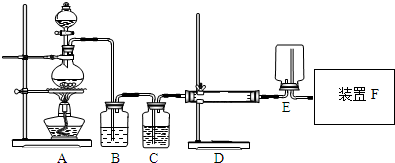
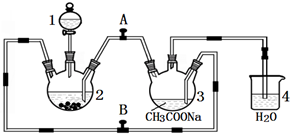 二價鉻不穩定,極易被氧氣氧化.醋酸亞鉻水合物{[Cr(CH3COO)2]2•2H2O,相對分子質量為376}是一種深紅色晶體,不溶于冷水和醚,易溶于鹽酸,是常用的氧氣吸收劑.實驗室中以鋅粒、CrCl3溶液、醋酸鈉溶液和鹽酸為主要原料制備醋酸亞鉻水合物,其裝置如圖所示:
二價鉻不穩定,極易被氧氣氧化.醋酸亞鉻水合物{[Cr(CH3COO)2]2•2H2O,相對分子質量為376}是一種深紅色晶體,不溶于冷水和醚,易溶于鹽酸,是常用的氧氣吸收劑.實驗室中以鋅粒、CrCl3溶液、醋酸鈉溶液和鹽酸為主要原料制備醋酸亞鉻水合物,其裝置如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,正丁烷的燃燒熱為-2878.0 kJ/mol | |
| B. | 相同質量的丙烷和丁烷分別完全燃燒,前者需要的氧氣多,產生的熱量也多 | |
| C. | 常溫下,CO的燃燒熱為566.0 kJ/mol | |
| D. | 人類利用的能源都是通過化學反應獲得的 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
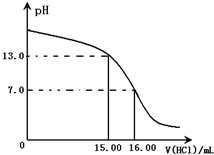 Ⅰ.某研究性學習小組用一定物質的量濃度的鹽酸滴定10.00mL某濃度的NaOH溶液,滴定時使用pH計精確測量滴定過程中溶液的pH變化(溫度為25℃),并繪制出滴定過程中溶液pH的變化曲線(如圖).
Ⅰ.某研究性學習小組用一定物質的量濃度的鹽酸滴定10.00mL某濃度的NaOH溶液,滴定時使用pH計精確測量滴定過程中溶液的pH變化(溫度為25℃),并繪制出滴定過程中溶液pH的變化曲線(如圖).| 實驗步驟 | 設計這一步驟的目的 |
| (1)將配制的氫氧化鈉溶液加熱 | ① |
| (2)在加熱后的溶液中滴加酚酞,并在上方滴一些植物油 | ②利用植物油隔絕空氣 |
| 實驗方法 | 觀察到的現象 | 結論 |
| 方案一:分別配制不同物質的量濃度的氫氧化鈉溶液,然后各滴加數滴酚酞溶液. | 濃度大的溶液中紅色會消失 | 紅色消失與氫氧化鈉溶液的濃度大小有關 |
| 方案二:向原紅色消失的溶液中加 ①(填試劑名稱) | ② |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com