
分析 (1)根據恒溫恒容,體積之比等于物質的量之比,再利用三段式進行計算;
(2)若乙中W%=40%,說明在恒溫恒容條件下,①和②為等效平衡,建立平衡的過程中乙壓強有變化,則按化學計量數轉化到左邊,滿足n(A)=4mol、n(B)=2mol,據此計算x.
解答 解:(1)設達平衡時B轉化了nmol
2A(g)+B(g)?xC(g),
開始(mol) 4 2 0
轉化(mol) 2n n xn
平衡(mol)4-2n 2-n xn
因為C的體積分數為40%,則有$\frac{xn}{4-2n+2-n+xn}$×100%=40%,解得xn=4-2n
所以A的體積分數為=$\frac{4-2n}{4-2n+2-n+xn}$×100%=40%
故答案:40%;
(2)若乙中W%=40%,說明在恒溫恒容條件下,①和②為等效平衡,建立平衡的過程中乙壓強有變化,則按化學計量數轉化到左邊,滿足n(A)=4mol、n(B)=2mol,故1mol+$\frac{2×3mol}{x}$=4,解得x=2,帶入(1)則平衡時A為2mol,B為1mol,C為2mol,所以乙中平衡向逆反應進行,故壓強增大;
故答案為:2;遞增.
點評 本題考查了化學平衡的計算、等效平衡等,難度中等,注意等效平衡的判斷及其應用,有利于提高學生靈活運用基礎知識解決實際問題的能力及化學計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 達到平衡時c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固體后,溶液中c (Cu2+)、c (Fe2+)都減小 | |
| D. | 該反應平衡常數 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
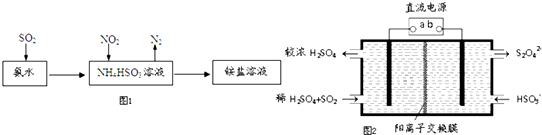 SO2和NOx都是大氣污染物.
SO2和NOx都是大氣污染物.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
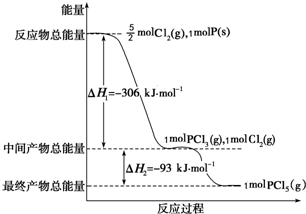 紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g).反應過程和能量關系如圖所示(圖中的△H表示生成1mol產物的數據).
紅磷P(s)和Cl2(g)發生反應生成PCl3(g)和PCl5(g).反應過程和能量關系如圖所示(圖中的△H表示生成1mol產物的數據).查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗次數 | 待測氫氧化鈉溶液體積(mL) | 標準鹽酸體積(mL) | NaOH溶液濃度(mol/L) | ||
| 初讀數 | 末讀數 | 體積 | |||
| 1 | 20.00 | 0.50 | 20.70 | 20.20 | 0.1059 |
| 2 | 20.00 | 6.00 | 26.00 | 20.00 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
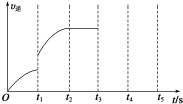 一定溫度下在體積為5L的密閉容器中發生可逆反應.
一定溫度下在體積為5L的密閉容器中發生可逆反應.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 兩途徑最終達到平衡時,體系內混合氣體的百分組成相同 | |
| B. | 兩途徑最終達到平衡時,體系內混合氣體的百分組成不同 | |
| C. | 途徑Ⅰ到達平衡所用時間一定等于途徑Ⅱ到達平衡所用時間 | |
| D. | 達平衡時,途徑Ⅰ所得混合氣體的密度等于途徑Ⅱ所得混合氣密度的一半 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液的PH=4 | |
| B. | 升高溫度,溶液的PH增大 | |
| C. | 稀釋時溶液中所有離子的濃度都減少 | |
| D. | 此酸的電離平衡常數約為1×10-9 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com