
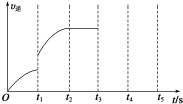
 一定溫度下在體積為5L的密閉容器中發生可逆反應.
一定溫度下在體積為5L的密閉容器中發生可逆反應.分析 Ⅰ.(1)化學平衡常數等于生成物濃度冪之積與反應物濃度冪之積的比,根據化學平衡常數表達式確定氣態反應物和生成物,根據元素混合確定固態或液態物質;
(2)可逆反應達到平衡狀態時,正逆反應速率相等,反應體系中各物質的物質的量、物質的量濃度、百分含量以及由此引起的一系列物理量不變;
II(1)v(H2)=$\frac{\frac{△n}{V}}{△t}$;
(2)固態物質的多少不影響平衡移動;溫度不變,化學平衡常數不變,再加入1molH2O(g) 再次達到平衡夠,H2的物質的量為原來的2倍;
(3)t1時改變條件,逆反應速率增大,且與原來平衡點沒有接觸點,可能是氫氣濃度、使用催化劑等.
解答 解:Ⅰ.(1)根據平衡常數的定義,生成物濃度的冪之積與反應物濃度的冪之積之比為平衡常數,結合元素守恒知,反應物中還有C,所以該反應的化學方程式為C(s)+H2O(g)?CO(g)+H2 (g);
故答案為:C(s)+H2O(g)?CO(g)+H2 (g);
(2)A.反應前后氣體的物質的量之和增大、氣體的質量增大,混合氣體的平均相對分子質量改變,當容器中氣體的平均相對分子質量不隨時間而變化時,正逆反應速率相等,反應達到平衡狀態,故正確;
B.v正(H2O)=v逆(H2)=v逆(H2O),正逆反應速率相等,反應達到平衡狀態,故正確;
C.反應前后氣體的質量增大、容器體積不變,則容器內密度增大,當容器中氣體的密度不隨時間而變化時,正逆反應速率相等,反應達到平衡狀態,故正確;
D.反應前后容器中總的物質的量不變,所以不能據此判斷平衡狀態,故錯誤;
E.無論反應是否達到平衡狀態,都存在消耗n mol H2的同時消耗n mol CO,所以不能據此判斷平衡狀態,故錯誤;
故選ABC;
II(1)v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.35-0.20}{5}}{{t}_{2}-{t}_{1}}$mol/(L.s)=$\frac{0.03}{{t}_{2}-{t}_{1}}$mol•L-1•s-1;
故答案為:$\frac{0.03}{{t}_{2}-{t}_{1}}$mol•L-1•s-1;
(2)Fe是固體,Fe的多少不影響平衡移動,所以平衡不移動;3Fe+4H2O=Fe3O4+4H2,化學平衡常數K=$\frac{{c}^{4}({H}_{2})}{{c}^{4}({H}_{2}O)}$,再加入1molH2O(g),濃度增大一倍,再次達到平衡,化學平衡常數不變,則H2的物質的量為原來的2倍,所以為0.35mol×2=0.7mol,故答案為:不;0.7;
(3)t1時改變條件,逆反應速率增大,且與原來平衡點沒有接觸點,改變的條件可能是使用了催化劑、升高溫度、增大壓強、增大H2的濃度(任答兩條),
故答案為:使用了催化劑、升高溫度、增大壓強、增大H2的濃度(任答兩條).
點評 本題考查化學平衡狀態判斷、化學平衡計算、外界條件對化學平衡影響等知識點,側重考查學生理解分析判斷及計算能力,注意:化學平衡常數只與溫度有關,與物質濃度無關,題目難度不大.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
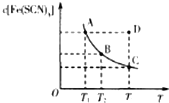 已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡時Fe(SCN)3的物質的量濃度與溫度T的關系如圖所示,則下列說法正確的是( )
已知:FeCl3(aq)+3KSCN(aq)?3KCl(aq)+Fe(SCN)3(aq),平衡時Fe(SCN)3的物質的量濃度與溫度T的關系如圖所示,則下列說法正確的是( )| A. | A點與B點相比,A點的血紅色沉淀更多 | |
| B. | 加入KCl固體可以使溶液由D點變到C點 | |
| C. | 反應處于D點時,一定有V(正)<V(逆) | |
| D. | 若T1、T2溫度下的平衡常數分別為K1、K2,K1<K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
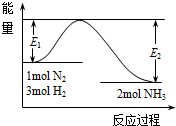 氨是氮循環過程中的重要物質,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循環過程中的重要物質,氨的合成是目前普遍使用的人工固氮方法.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2NH3(g)△H=-92kJ•mol-1.
2NH3(g)△H=-92kJ•mol-1.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 二氧化硫和氮的氧化物是常用的工業原料,但也是大氣的主要污染物.綜合治理其污染是環境化學當前的重要研究內容之一.
二氧化硫和氮的氧化物是常用的工業原料,但也是大氣的主要污染物.綜合治理其污染是環境化學當前的重要研究內容之一.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com