
| A. | 改變條件,反應物的轉化率增大,平衡常數也一定增大 | |
| B. | 常溫下,V1L pH=12的NaOH溶液與V2L pH=2的HA溶液混合,若混合液顯中性,則V1≤V2 | |
| C. | 在0.1mol•L-1 NaHCO3溶液中,加入少量NaOH固體,Na+和CO32-的離子濃度均增大 | |
| D. | 反應2NO2(g)?N2O4(g)△H<O,升高溫度該反應平衡常數增大 |
分析 A.平衡常數只與溫度有關,溫度不變,平衡常數不變,轉化率增大,不一定是改變溫度;
B.如HA為強酸,則V1=V2,如HA為弱酸,HA的濃度較大;
C.碳酸氫鈉和氫氧化鈉反應生成碳酸鈉;
D.反應是放熱反應,升溫平衡向吸熱反應方向進行;
解答 解:A.平衡常數只與溫度有關,溫度不變,平衡常數不變,轉化率增大,不一定是改變溫度使平衡向正反應移動,故轉化率增大,平衡常數不一定增大,故A錯誤;
B.如HA為強酸,則V1=V2,如HA為弱酸,HA的濃度較大,則V1>V2,故B錯誤;
C.碳酸氫鈉和氫氧化鈉反應生成碳酸鈉,NaHCO3+NaOH=Na2CO3+H2O,Na+和CO32-的離子濃度均增大,故C正確;
D.反應2NO2(g)?N2O4(g)△H<O,升高溫度平衡逆向進行,該反應平衡常數減小,故D錯誤;
故選C.
點評 本題考查了電解質的電離、鹽類的水解以及平衡影響因素的分析、酸堿反應后溶液酸堿性判斷等知識點,注意平衡常數隨溫度變化,題目難度中等.


科目:高中化學 來源: 題型:解答題
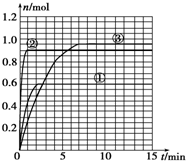 某溫度時,在2L密閉容器中氣態物質X和Y反應生成氣態物質Z和W,它們的物質的量隨時間的變化如下表所示.
某溫度時,在2L密閉容器中氣態物質X和Y反應生成氣態物質Z和W,它們的物質的量隨時間的變化如下表所示.| t/min | X/mol | Y/mol | Z/mol | W/mol |
| 0 | 2.00 | 1.00 | 0.00 | 0.00 |
| 1 | 1.80 | 0.80 | 0.20 | 0.10 |
| 3 | 1.50 | 0.50 | 0.50 | 0.25 |
| 5 | 1.30 | 0.30 | 0.70 | 0.35 |
| 9 | 1.10 | 0.10 | 0.90 | 0.45 |
| 10 | 1.10 | 0.10 | 0.90 | 0.45 |
| 14 | 1.10 | 0.10 | 0.90 | 0.45 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在元素周期表中,Y所在族的元素都是活潑金屬元素 | |
| B. | 37Z原子核電子數為20 | |
| C. | X與Y能形成YX型化合物 | |
| D. | 在常溫下,Z的單質與氫氣一定能大量共存 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液:Cu2+、H+、Cl-、SiO32- | |
| B. | NaAlO2溶液:NH4+、H+、Cl-、CO32- | |
| C. | NaHCO3溶液:K+、Al3+、SO42-、NO3- | |
| D. | 能使pH試紙呈紅色的溶液:Na+、K+、Fe3+、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 金屬鈦性能優越,被譽為繼Fe、Al后應用廣泛的“第三金屬”.
金屬鈦性能優越,被譽為繼Fe、Al后應用廣泛的“第三金屬”.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com