
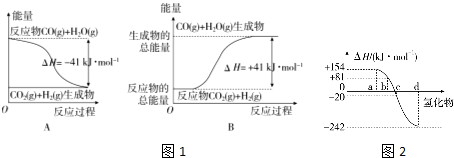
分析 (1)①圖象分析反應物能量高于生成物可知為放熱反應,標注物質聚集狀態和對應反應的焓變寫出熱化學方程式;
②圖象分析生成物能量高于反應物可知為吸熱反應,則根據圖象該反應的熱化學方程式為:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,又氣態水變成液態水還要放熱,據此判斷;
(2)根據熱化學方程式的書寫方法可知,化學計量數與反應熱成正比,并注意標明物質的聚集狀態來解答;
(3)①根據元素周期律,同一主族元素非金屬性越強,生成氣態氫化物越容易,氣態氫化物越穩定;而根據熱力學,能量越低越穩定,以此進行判斷;
②根據圖象判斷出abcd對應的各氫化物,根據焓變的大小書寫熱化學方程式.
解答 解:(1)圖象分析可知為放熱反應,反應的熱化學方程式為:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol,
故答案為:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol;
②圖象分析生成物能量高于反應物可知為吸熱反應,則根據圖象該反應的熱化學方程式為:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,
A.將反應的反應物與生成物弄反了,該反應的熱化學方程式為:CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41kJ/mol,故A錯誤;
B.生成物的能量比反應物的能量高,故該反應為吸熱反應,故B正確;
C.生成物的能量比反應物的能量高,故該反應為吸熱反應,故C錯誤;
D.因為氣態水變成液態水還要放熱,當H2O為液態時,其反應熱值大于41kJ/mol,則△H<+41kJ•mol-1,故D錯誤;
故答案為:B;
(2)16g固體硫完全燃燒時放出148.4kJ的熱量,則1molS完全燃燒時放出放出296.8kJ熱量,則熱化學方程式為:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol,
故答案為:S(s)+O2(g)=SO2(g)△H=-296.8 kJ/mol;
(3)①非金屬元素氫化物的穩定性與生成1mol氫化物時的△H的關系為:根據元素周期律,同一主族元素非金屬性越強,生成氣態氫化物越容易,氣態氫化物越穩定,而能量越低越穩定,所以a、b、c、d依次為:H2Te、H2Se、H2S、H2O,
故答案為:非金屬元素氫化物越穩定,△H越小,反之亦然;
②由①可知,b為硒化氫的生成熱數據,則硒化氫分解吸熱,△H=-81kJ/mol,所以H2Se發生分解反應的熱化學反應方程式為:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案為:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
點評 本題考查了化學反應的能量變化,圖象分析判斷以及蓋斯定律的應用,注意反應熱△H=反應物能量總和-生成物能量總和,題目難度中等,側重于考查學生的分析能力和計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 難溶電解質的溶度積越小,溶解度越大 | |
| B. | 可以通過沉淀反應使雜質離子完全沉淀 | |
| C. | 難溶電解質的溶解平衡是一種動態平衡 | |
| D. | AgCl固體在等濃度的NaCl、CaCl2溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
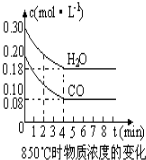 在一體積為10L的容器中,通入一定量的CO和H2O,在850℃時發生如下反應:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0,CO和H2O濃度變化如圖.
在一體積為10L的容器中,通入一定量的CO和H2O,在850℃時發生如下反應:CO(g)+H2O(g)?CO2(g)+H2 (g)△H<0,CO和H2O濃度變化如圖.| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫化鋅轉化成銅藍的離子方程式為ZnS(s)+Cu2+(aq)=Zn2+(aq)+CuS(s) | |
| B. | 在白色硫化鋅濁液中滴加硝酸鉛溶液,不會生成黑色沉淀(PbS) | |
| C. | 在水中的溶解度:S(ZnS)>S(PbS)>S(CuS) | |
| D. | 若溶液中c(Cu2+)=1×10-10mol•L-1,則S2-已完全轉化成CuS |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.0 mol/L | B. | 0.50 mol/L | C. | 1.0 mol/L | D. | 0.10 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解AlCl3飽和溶液,可制得金屬鋁 | |
| B. | 鋁熱反應不僅被用于焊接鋼軌,而且還常被用于冶煉熔點較高的金屬 | |
| C. | 鋁比鐵活潑,但鋁制品比鐵制品在空氣中耐腐蝕 | |
| D. | Al2O3、MgO的熔點很高,可用于制作耐高溫材料 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com