
| A. | 溴蒸汽被木炭吸附 | B. | 燒堿熔化 | ||
| C. | 碳酸鈣高溫分解 | D. | HCl溶于水 |
 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:解答題
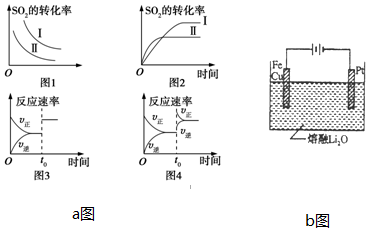
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu做還原劑 | B. | H2做氧化劑 | ||
| C. | 銅元素的化合價降低 | D. | 銅是氧化產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
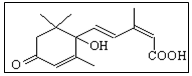 國慶期間對大量盆栽鮮花施用了S-誘抗素制劑,以保證鮮花盛開.S-誘抗素的分子結構如圖,下列關于該物質的說法正確的是( )
國慶期間對大量盆栽鮮花施用了S-誘抗素制劑,以保證鮮花盛開.S-誘抗素的分子結構如圖,下列關于該物質的說法正確的是( )| A. | 其分子式為C15H18O4 | |
| B. | 分子中存在4種含氧官能團 | |
| C. | 既能發生加聚反應,又能發生縮聚反應 | |
| D. | 1mol該有機物最多可與4molBr2發生加成反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
| 物質 | X | Y | Z |
| 初始濃度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡濃度(mol/L) | 0.05 | 0.05 | 0.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 復分解反應 | B. | 置換反應 | C. | 化合反應 | D. | 非氧化還原反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com