
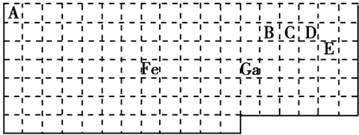
分析 (1)Ga位于第四周期第IIIA族,最外層有3個電子;
(2)元素周期表五區的劃分是根據最后排入的電子名稱命名的;根據化合物的化合價代數和為0分析;
(3)價電子數相同和原子數相同的微粒互稱等電子體;
(4)先根據價層電子對互斥理論判斷價層電子對,然后再確定采取的雜化方式;
(5)價層電子對數=σ鍵電子對數+中心原子上的孤電子對數,根據價層電子對數判斷微粒構型;根據元素周期表知,B、C、D、E分別是C、N、O、Cl是四種元素,若化合價的絕對值+原子最外層電子數=8,分子中每個原子最外層都達到8電子穩定結構,據此分析.
解答 解:(1)Ga位于第四周期第IIIA族,最外層有3個電子,其最外層電子排布式為4s24p1;
故答案為:4s24p1;
(2)元素周期表五區的劃分是根據最后排入的電子名稱命名的.Fe原子是26號元素,Fe原子的基態核外電子排布式為:1s22s22p63s23p63d64s2,
這些電子排列時遵循能量最低原理(先排能量低的后排能量高的),這些能級的能量大小順序為:1s<2s<2p<3s<3p<4s<3d,
根據能量最低原理先排4s電子后排3d電子,所以 最后排入的是3d電子,根據命名規則屬d區,根據化合物化合價的代數和為0,Fe與CO易形成配合物Fe(CO)5化合價的代數和為0,CO的化合價的代數和為0,
故答案為:d;0;
(3)根據等電子體的定義,CO的等電子體必須是雙原子分子或離子,且電子總數相等.對于原子,原子序數=原子核外電子總數,所以,如果是分子,只要原子序數之和相等即可.CO中C是6號元素,O是8號元素,原子序數之和為14,N是7號元素,且可形成雙原子分子,所以分子是N2.
故答案為:N2、CN-;
(4)在CH4中價層電子對數=σ鍵電子對數(4)+中心原子上的孤電子對數(0),所以碳原子采取sp3雜化.在CO分子中價層電子對數=σ鍵電子對數(1)+中心原子上的孤電子對數(1),所以碳原子采取sp雜化.CH3OH中,價層電子對數=σ鍵電子對數(4)+中心原子上的孤電子對數(0),所以碳原子采取sp3雜化.
故答案為:CH4、CH3OH;
(5)根據元素周期表知,E是Cl元素,D是O元素,ED4-是ClO4-離子,價層電子對數=σ鍵電子對數+中心原子上的孤電子對數,價層電子對數=4+$\frac{1}{2}$(7+1-4×2)=4,根據VSEPR理論預測ED4-離子的空間構型為正四面體型.
C、N、O、Cl是四種元素,兩兩形成的化合物且每個原子最外層都達到8電子穩定結構的化合物有:CO2、N2O3、CCl4;
故答案為:正四面體;CO2、N2O3、CCl4.
點評 本題考查基態原子或離子的核外電子排布或最外層電子排布、分子中原子采取的雜化方式、對于元素周期表,學習時要記住它的周期、族的劃分,要熟記前36號元素,五區的劃分、邊界、劃分依據等都要掌握,在學習中要靈活掌握根據VSEPR理論預測分子或離子的空間構型是學習的重點,也是近幾年高考的熱點.


科目:高中化學 來源: 題型:選擇題
| A. | 0.4△H1+0.05△H3 | B. | 0.4△H1+0.05△H2 | C. | 0.4△H1+0.1△H3 | D. | 0.4△H1+0.2△H3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
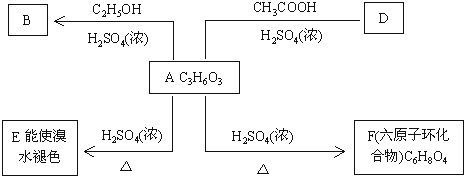

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CO2的電子式 | B. | Cl-的結構示意圖: | ||
| C. | 乙烯的結構簡式C2H4 | D. | Z質量數為37的氯原子${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NO:0.06mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.00125mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素編號 元素性質 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半徑 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 最低化合價 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 現有六種元素,其中B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題
現有六種元素,其中B、C、D、E為短周期主族元素,F、G為第四周期元素,它們的原子序數依次增大.請根據下列相關信息,回答問題| B元素原子的核外p電子數比s電子數少1 |
| C原子的第一至第四電離能分別是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p軌道全滿或半滿 |
| E元素的主族序數與周期數的差為4 |
| F 是前四周期原子電子軌道表示式中單電子數最多的元素 |
| G在周期表的第十一列 |
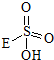 →
→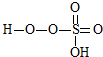 +HE,請寫出橫線上物質的結構式.
+HE,請寫出橫線上物質的結構式.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 (X為鹵素原子)
(X為鹵素原子) 的物質,該物質是一種香料.請根據下述路線,回答下列問題:
的物質,該物質是一種香料.請根據下述路線,回答下列問題:
 .
. .
.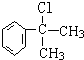 的水解產物
的水解產物 不能經氧化反應⑥而得到產品,導致產率低.
不能經氧化反應⑥而得到產品,導致產率低. 等.
等.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com