
分析 (1)焓變△H<0為放熱反應,△H>0為吸熱反應;
(2)燃燒熱是指1mol可燃物完全燃燒生成穩定氧化物放出的熱量,單位為kJ/mol;
(3)由H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ/mol,可知1mol氫氣燃燒生成液態水放出的熱量為285.8kJ,根據n=$\frac{m}{M}$計算氫氣的物質的量,進而計算放出的熱量;
(4)已知:③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由蓋斯定律,④-③可得CO燃燒的熱化學方程式;
(5)制水煤氣發生反應:C(s)+H2O(g)=CO(g)+H2(g),根據蓋斯定律③-①可得C(s)+H2O(g)=CO(g)+H2(g),反應熱也進行相應計算,可得熱化學方程式.
解答 解:(1)焓變△H<0為放熱反應,△H>0為吸熱反應,故上述反應中①屬于吸熱反應,故答案為:①;
(2)燃燒熱是指1mol可燃物完全燃燒生成穩定氧化物放出的熱量,單位為kJ/mol,由④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,可知碳的燃燒熱為:393.5kJ/mol,故答案為:393.5kJ/mol;
(3)由H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ/mol,可知1mol氫氣燃燒生成液態水放出的熱量為285.8kJ,10g氫氣的物質的量為$\frac{10g}{2g/mol}$=5mol,燃燒生成液態水,放出的熱量為 285.8kJ×$\frac{5mol}{1mol}$=1429kJ,故答案為:1429kJ;
(4)已知:③C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
由蓋斯定律,④-③可得CO燃燒的熱化學方程式:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol,
故答案為:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ/mol;
(5)制水煤氣發生反應:C(s)+H2O(g)=CO(g)+H2(g),根據蓋斯定律③-①可得C(s)+H2O(g)=CO(g)+H2(g),則△H=(-110.5kJ/mol)-285.8kJ/mol=-396.3kJ/mol,故熱化學方程式為:C(s)+H2O(g)=CO(g)+H2(g),則△H=-396.3kJ/mol,
故答案為:C(s)+H2O(g)=CO(g)+H2(g)△H=-396.3kJ/mol.
點評 本題考查熱化學方程式書寫、反應熱計算、燃燒熱等,比較基礎,注意運用蓋斯定律書寫熱化學方程式、進行反應熱計算.


 云南師大附小一線名師提優作業系列答案
云南師大附小一線名師提優作業系列答案 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:解答題
| 次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羥基氧原子數 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中強酸 | 強酸 | 最強酸 |
 .H3PO3和H3AsO3與過量的NaOH溶液反應的化學方程式分別是:
.H3PO3和H3AsO3與過量的NaOH溶液反應的化學方程式分別是:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將銅絲插入濃硫酸加熱,反應后把水加入反應器中,觀察硫酸銅溶液的顏色 | |
| B. | 常溫下將銅絲伸入盛滿氯氣的集氣瓶中,觀察CuCl2的生成 | |
| C. | 金屬鈉放入硫酸銅溶液中可以置換出金屬銅 | |
| D. | 將表面有銅綠[Cu2(OH)2CO3]的銅器放入鹽酸中浸泡,除去銅綠 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
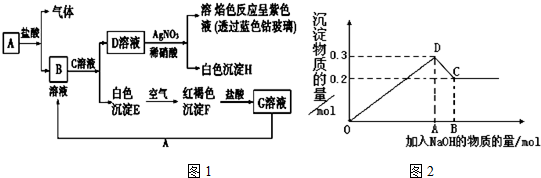
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 離子組 | 所加試劑 | 離子方程式 |
| A | Mg2+、Fe3+、NO3- | KSCN溶液 | Fe3++3SCN-═Fe(SCN)3↓ |
| B | NH4+、HCO3-、Cl- | 過量NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| C | Fe2+、Cl-、H+ | KNO3溶液 | 3Fe2++NO3-+4H+═NO↑+2H2O+3Fe3+ |
| D | K+、H+、C6H5O- | Na2CO3溶液 | 2H++CO32-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
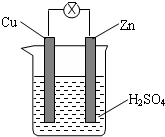
| A. | 燒杯中溶液逐漸呈藍色 | B. | 鋅片逐漸溶解 | ||
| C. | 電子由銅片通過導線流向鋅片 | D. | 該裝置能夠將電能轉化為化學能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫下,醋酸鈉與醋酸的混合溶液pH=7,c(Na+)=c(CH3COO-) | |
| B. | 0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 常溫下,將pH=1的醋酸溶液稀釋100倍后,水電離的c(H+)=10-11mol/L | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚氯乙烯分子中含碳碳雙鍵 | B. | 以淀粉為原料可制取乙酸乙酯 | ||
| C. | 戊烷有3種同分異構體 | D. | 油脂的皂化反應屬于水解反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com