
分析 由信息可知,加入鐵反應還生成氫氣,則一定量的CuO粉末與0.5L稀硫酸充分反應,發生CuO+H2SO4═CuSO4+H2O,且硫酸剩余,然后加Fe,發生Fe+CuSO4═FeSO4+Cu、Fe+H2SO4═FeSO4+H2↑,然后結合氣體的體積及質量差計算.
解答 解:(1)氧化銅能與硫酸反應生成硫酸銅和水,生成的硫酸銅能與鐵反應生成硫酸亞鐵和銅,生成的銅附著在鐵的表面,鐵能與硫酸反應生成氫氣,設生成0.02g氫氣需要鐵的質量為x則有
Fe+H2SO4═FeSO4+H2↑
56 1mol 2
x 0.01mol 0.02g
$\frac{56}{x}=\frac{2}{0.02}$,
x=0.56g,其物質的量為$\frac{0.56g}{56g/mol}$=0.01mol,
答:與硫酸反應的鐵的物質的量為0.01mol;
(2)與硫酸銅反應的鐵的質量為50g-0.56g=49.44g,反應后鐵棒的質量為50.24g,說明鐵與硫酸銅反應時增重的質量為50.24g-49.44g=0.8g,設硫酸銅的質量為y,根據反應的化學方程式則有
Fe+CuSO4═FeSO4+Cu△m
56 160 64 8
y 0.8g
$\frac{160}{y}=\frac{8}{0.8g}$,
解得y=16g,
設氧化銅的質量為z.則有
CuO+H2SO4═CuSO4+H2O
80 160
z 16g
$\frac{80}{z}=\frac{160}{16g}$,解得z=8g,
答:此CuO粉末的質量為8g;
(3)原稀硫酸的物質的量濃度為:$\frac{0.01+\frac{16g}{160g}}{0.5L}$=0.22mol/L,答:原稀硫酸的物質的量濃度為0.22mol/L.
點評 本題考查了金屬活動性順序的應用以及根據化學方程式的計算,注意發生的化學反應及反應中過量的分析是解答本題的關鍵,差量法計算為解答的難點.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
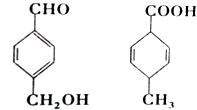
| A. | 互為同分異構體 | |
| B. | 均能使酸性高錳酸鉀溶液褪色 | |
| C. | 均可以發生加成和取代反應 | |
| D. | 既能用紅外光譜區分,也可以用核磁共振氫譜區分 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3•H2O+HCl═NH4Cl+H2O | B. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | ||
| C. | Al(OH)3+3HCl═AlCl3+3H2O | D. | KOH+HNO3═KNO3+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
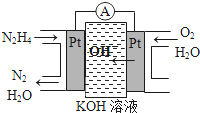 某短周期元素的原子最外層電子數為次外層的2倍,其單質甲可發生如下反應:
某短周期元素的原子最外層電子數為次外層的2倍,其單質甲可發生如下反應:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
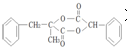 )是一種新型香料的主要成分之一.I的合成路線如下(部分產物和部分反應條件略去):
)是一種新型香料的主要成分之一.I的合成路線如下(部分產物和部分反應條件略去):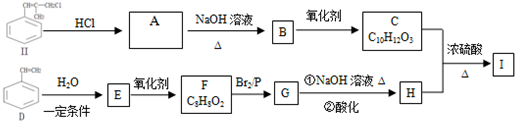

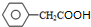 .
. .
. (寫結構簡式).
(寫結構簡式).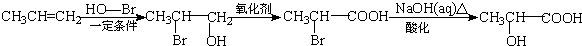 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 裝置一中鐵片的生銹速度比裝置二要慢 | |
| B. | 裝置一中Ⅰ電極上有氣泡冒出 | |
| C. | 一段時間后,兩個裝置中II和IV電極附近出現紅色 | |
| D. | 裝置二中加入少量KSCN溶液,溶液變為血紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定增大 | B. | 一定減小 | ||
| C. | 一定不變 | D. | 可能減小也可能不變 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com