
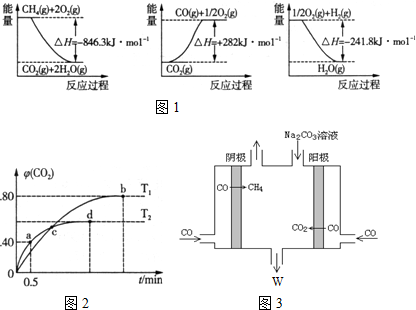
分析 Ⅰ(1)根據能量圖書寫各自的熱化學方程式,再通過蓋斯定律計算;
(2)燃料電池中,負極上投放燃料,負極上失電子發生氧化反應;
(3)計算氧氣的物質的量,進而計算生成二氧化碳的物質的量,根據n(NaOH)與n(CO2)比例關系判斷反應產物,進而計算溶液中電解質物質的量,結合鹽類水解與電離等判斷;
Ⅱ(4)根據起始量和a點時CO2的體積分數(即物質量分數),列式計算即可求出從反應開始至a點時的反應速率為v(CO);
(5)根據b點時CO2的體積分數φ(CO2)求出CO和CO2的平衡濃度進而求出T1時化學平衡常數K;
(6)A.因為條件為恒容,而反應前后氣體質量變化,所以容器內氣體密度是變量,當不變時表明反應達到平衡狀態;
B.c點為交點,各氣體物質的量分別相等;
C.反應前后氣體體積不變,壓強變化對平衡無影響;
D.b點比d點時生成物CO2體積分數大,說明進行的程度大,則化學平衡常數:Kb>Kd
(7)由此電解原理可知,陽極失去電子生成二氧化碳氣體,加入碳酸鈉,碳酸鈉與二氧化碳反應生成碳酸氫鈉,陰極CO得到電子生成甲烷氣體,據此解答即可;
解答 解:Ⅰ(1)由能量圖,得①CH4(g)+2O2(g)→CO2(g)+2H2O(g)△H=-846.3kJ•moL-1
②CO2(g)═CO(g)+$\frac{1}{2}$O2(g)△H=+282kJ•moL-1
③$\frac{1}{2}$O2(g)+H2(g)═H2O(g)△H=-241.8kJ•moL-1
①-③×3+②得CH4(g)+H2O(g)$\frac{\underline{\;高溫\;}}{\;}$CO(g)+3H2(g)△H=(-846.3+241.8×3+282)kJ•moL-1=+161.1kJ•moL-1;故答案為:+161.1;
(2)燃料電池中,負極上投放燃料所以投放甲烷的電極是負極,負極上失電子發生氧化反應,電極反應式為:CnH2nOn-4ne-+nH2O═nCO2+4nH+.
故答案為:CnH2nOn-4ne-+nH2O═nCO2+4nH+;
(3)參與反應的氧氣在標準狀況下體積為448mL,物質的量為 $\frac{0.448L}{22.4L/mol}$=0.02mol,根據電子轉移守恒可知,生成二氧化碳為 $\frac{0.02mol×4}{8}$=0.01mol,n(NaOH)=0.1L×0.15mol•L-1=0.015mol,n(NaOH):n(CO2)=0.015mol:0.01mol=3:2,發生發生2CO2+3NaOH=Na2CO3+NaHCO3+H2O,所以所得溶液中溶質的成分及物質的量之比為n(Na2CO3):n(NaHCO3)=1:1;溶液中碳酸根水解,碳酸氫根的水解大于電離,溶液呈堿性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氫根,故c(HCO3-)>c(CO32-),鈉離子濃度最大,水解程度不大,碳酸根濃度原大于氫氧根離子,故c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案為:n(Na2CO3):n(NaHCO3)=1:1;c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
Ⅱ(4)a點時:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
轉化量/mol x x
a點量/mol 4-x x
根據a點時CO2的體積分數φ(CO2)=$\frac{x}{4}$=0.40,得x=1.6mol
則從反應開始至a點時的反應速率為v(CO)=$\frac{1.6mol}{2L×0.5min}$=1.6mol•L-1•min-1,故答案為:1.6mol•L-1•min-1;
(5)T1時:5CO(g)+I2O5(s)?5CO2(g)+I2(s)
起始量/mol 4 0
轉化量/mol y y
b點量/mol 4-y y
根據b點時CO2的體積分數φ(CO2)=$\frac{y}{4}$=0.80,得y=3.2mol,c(CO)=0.4mol•L-1,c(CO2)=1.6mol•L-1
T1時化學平衡常數K=$\frac{c(CO{\;}_{2}){\;}^{5}}{c(CO){\;}^{5}}$=$\frac{1.6{\;}^{5}}{0.4{\;}^{5}}$=1024,
故答案為:1024;
(6)A.因為條件為恒容,而反應前后氣體質量變化,所以容器內氣體密度不變時,表明反應達到平衡狀態,故A正確;
B.c點為交點,氣體物質的量分別相等,所以兩種溫度下,體系中混合氣體的壓強不等,故B錯誤;
C.反應前后氣體體積不變,壓強變化對平衡無影響,所以增大壓強平衡不移動,CO的轉化率不變,故C正確;
D.b點比d點時生成物CO2體積分數大,說明進行的程度大,則化學平衡常數:Kb>Kd,故D正確;
故答案為:B;
(7)由此電解原理可知,陽極失去電子生成二氧化碳氣體,加入碳酸鈉,碳酸鈉與二氧化碳反應生成碳酸氫鈉,陰極CO得到電子生成甲烷氣體,據此離子反應方程式為:4CO+3CO32-+5H2O=6HCO3-+CH4↑,故答案為:4CO+3CO32-+5H2O=6HCO3-+CH4↑.
點評 本題考查蓋斯定律的應用、化學反應速率和化學平衡常數的相關計算、化學平衡移動原理、電離常數及離子濃度大小的比較等知識,綜合性很強,難度很大.


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:選擇題
| A. | 10aL | B. | (2a+b)L | C. | (b-a)L | D. | 無法計算 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸性AgNO3溶液 | B. | HCl溶液 | C. | 稀NaOH溶液 | D. | 酸性CuSO4溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 埃博拉病毒對化學藥品敏感,乙醇、次氯酸鈉溶液均可以將病毒氧化而達到消毒的目的 | |
| B. | 氣象環境報告中新增的“PM2.5”是對一種新分子的描述 | |
| C. | 用浸泡過高錳酸鉀溶液的硅藻土保鮮水果 | |
| D. | 施肥時,草木灰(有效成分為K2CO3)與NH4Cl混合使用效果更好 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 元素編號 | 元素性質或原子結構 |
| T | M層上的電子數是原子核外電子層數的2倍 |
| X | 最外層電子數是次外層電子數的2倍 |
| Y | 常溫下單質為雙原子分子,其氫化物的水溶液呈堿性, |
| Z | 元素最高正價是+7價 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X元素的氫化物的水溶液顯堿性 | |
| B. | Z元素的離子半徑大于W元素的離子半徑 | |
| C. | Z元素的單質在一定條件下能與X元素的單質反應 | |
| D. | Y元素的氧化物是含有極性鍵的非極性分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在元素周期表里,主族元素所在的族序數等于原子核外電子數 | |
| B. | 在元素周期表里,元素所在的周期序數等于原子核外電子層數 | |
| C. | 最外層電子數為8的粒子是稀有氣體元素的原子 | |
| D. | 元素的原子序數越大,其原子半徑也越大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com