
 研究人員發現了一種“水’’電池,其總反應為:5Mn02+2Ag+2NaCl=Na2Mn5O10+2AgCl.如圖用“水”電池為電源電解NaCl溶液的實驗中,X電極上有無色氣體逸出.下列有關分析正確的是( )
研究人員發現了一種“水’’電池,其總反應為:5Mn02+2Ag+2NaCl=Na2Mn5O10+2AgCl.如圖用“水”電池為電源電解NaCl溶液的實驗中,X電極上有無色氣體逸出.下列有關分析正確的是( )| A. | I為負極,其電極反應式為Ag+Cl--e-=AgCl | |
| B. | “水”電池內Na+不斷向負極作定向移動 | |
| C. | 每轉移1mole-,U型管中消耗0.5mol H2O | |
| D. | 開始時U型管中Y極附近pH逐漸增大 |
分析 X電極上有無色氣體逸出,應為陰極,生成氫氣,則Ⅰ為負極,Ⅱ為正極,根據電池總反應可判斷出反應中Ag的化合價升高,被氧化,Ag應為原電池的負極,AgCl是氧化產物;方程式中5MnO2生成1Na2Mn5O10,化合價共降低了2價,所以每生成1molNa2Mn5O10轉移2mol電子;在原電池中陰離子向負極移動,陽離子向正極移動,以形成閉合電路,以此解答該題.
解答 解:A.X電極上有無色氣體逸出,應為陰極,生成氫氣,則Ⅰ為負極,Ⅱ為正極,負極發生Ag+Cl--e-=AgCl,故A正確;
B.原電池工作時,陽離子向正極移動,故B錯誤;
C.每轉移1mole-,由2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$2OH-+H2↑+Cl2↑,可知生成0.5mol氫氣,消耗1mol水,故C錯誤;
D.Y為陽極,生成氯氣,氯氣與水反應呈酸性,pH減小,故D錯誤.
故選A.
點評 本題考查原電池的電極反應和離子的定向移動以及電化學的簡單計算,做題時要注意總電池反應式的判斷利用,運用兩極上的反應特點做題,分析Mn元素的化合價變化是該題的難點.


 課堂全解字詞句段篇章系列答案
課堂全解字詞句段篇章系列答案 步步高口算題卡系列答案
步步高口算題卡系列答案 點睛新教材全能解讀系列答案
點睛新教材全能解讀系列答案科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3遇少量酸可轉化為NaHCO3 | |
| B. | 在水中的溶解度Na2CO3比NaHCO3大 | |
| C. | NaHCO3能與Ca(OH)2溶液反應,而Na2CO3不能 | |
| D. | 與同濃度的鹽酸反應時,NaHCO3比Na2CO3劇烈 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 某反應歷程,假設體系的始態為S,終態為L,它們之間的變化用兩段弧線(可以包含著任意數目的中間步驟)連接如圖所示.( )
某反應歷程,假設體系的始態為S,終態為L,它們之間的變化用兩段弧線(可以包含著任意數目的中間步驟)連接如圖所示.( )| A. | 一定有△H1<0 | B. | 一定有△H2<0 | ||
| C. | 一定有△H1<0,△H2>0 | D. | 一定有△H1+△H2=0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
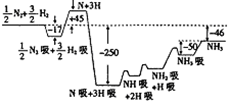 2007年度諾貝爾化學獎獲得者格哈德•埃特爾建立了合成氨反應機理,T=673K時,各步反應的能量變化如圖所示,圖中的能量單位為kJ•mol-1.(注:圖中“吸”表示在催化劑表面的吸附)請回答下列問題:
2007年度諾貝爾化學獎獲得者格哈德•埃特爾建立了合成氨反應機理,T=673K時,各步反應的能量變化如圖所示,圖中的能量單位為kJ•mol-1.(注:圖中“吸”表示在催化劑表面的吸附)請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D |
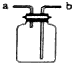 | 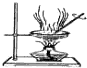 | 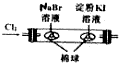 | 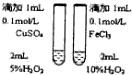 |
| 用該裝置排空氣法收集H2、CO2、Cl2等氣體 | 蒸干AlCl3飽和溶液制備AlCl3晶體 | 可以證明氧化性Cl2>Br2>I2 | 比較不同催化劑對反應速率的影響 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下生成N的體積為$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的質量為17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物質的量為$\frac{bV}{1000}$mol | |
| D. | 與合金反應的硝酸的物質的量為($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
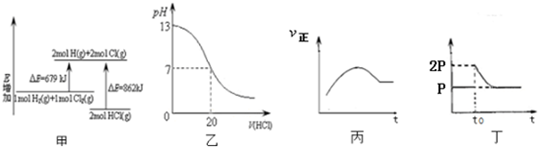
| A. | 圖甲表示H2(g)+Cl2(g)=2HCl(g)的能量變化,則該反應的反應熱△H=+183 kJ/mol | |
| B. | 圖乙表示室溫時用0.1 mol/L鹽酸滴定20 mL 0.1 mol/LNaOH溶液,溶液pH變化 | |
| C. | 圖丙表示向恒容絕熱的密閉容器中通入A和B,發生2A (g)+B (g)?2C(g)反應,其正反應速率隨時間變化的示意圖,則該反應為吸熱反應 | |
| D. | 圖丁表示在恒溫密閉容器中,2BaO2(s)?2BaO(s)+O2(g)達到平衡,t0時刻將容器體積縮小為原來的1/2,體系重新達到平衡過程體系壓強的變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 50mL 0.55mol/L鹽酸與50mL 0.50mol/LNaOH溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱,回答下列問題:
50mL 0.55mol/L鹽酸與50mL 0.50mol/LNaOH溶液在如圖所示的裝置中進行中和反應,通過測定反應過程中所放出的熱量可計算中和熱,回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com