
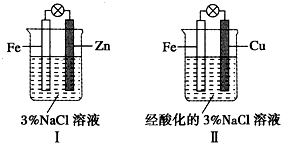
| A. | Ⅰ是驗證犧牲陽極的陰極保護法的實驗裝置 | |
| B. | Ⅰ和Ⅱ中負極反應式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正極反應式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分別加入少量K3Fe(CN)6溶液,均有藍色沉淀 |
分析 A.Ⅰ裝置是原電池,鋅做負極,鐵做正極,發生的是鋅的吸氧腐蝕;
B.Ⅰ中原電池負極為鋅,Ⅱ為原電池,鐵做負極;
C.Ⅰ裝置是電解質溶液時中性溶液,屬于吸氧腐蝕,Ⅱ裝置中電解質溶液時酸性溶液,屬于析氫腐蝕;
D.Ⅰ裝置中不能生成亞鐵離子,Ⅱ裝置中負極鐵失電子生成亞鐵離子.
解答 解:A.Ⅰ裝置是原電池,鋅做負極,鐵做正極,發生的是鋅的吸氧腐蝕,是驗證犧牲陽極的陰極保護法的實驗裝置,故A正確;
B.Ⅰ中原電池負極為鋅,電極反應為Zn-2e-=Zn2+,Ⅱ為原電池,鐵做負極,電極反應為Fe-2e-=Fe2+,故B錯誤;
C.Ⅰ裝置是電解質溶液時中性溶液,屬于吸氧腐蝕,正極電極反應為:O2+2H2O+4e-=4OH-,Ⅱ裝置中電解質溶液時酸性溶液,屬于析氫腐蝕,正極電極反應為2H++2e-=H2↑,故C錯誤;
D.加入少量K3Fe(CN)6溶液,有藍色沉淀是亞鐵離子的性質,Ⅰ裝置中不能生成亞鐵離子,Ⅱ裝置中負極鐵失電子生成亞鐵離子,故D錯誤;
故選A.
點評 本題考查了原電池原理的分析判斷,注意電解質溶液不同,電極與電極反應變化,掌握基礎是關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Na、Mg、Al原子的失電子能力逐漸減弱 | |
| B. | Si、P、S元素的最高正化合價依次降低 | |
| C. | C、N、O的原子半徑依次減小 | |
| D. | Cl、Br、I的氣態氫化物的穩態性依次減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
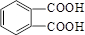 +n HOCH2CH2OH
+n HOCH2CH2OH
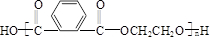 +(2n-1)H2O.
+(2n-1)H2O.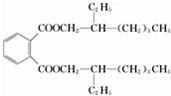 .
.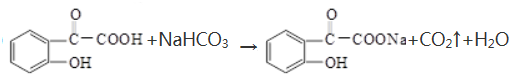 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸化的淀粉溶液 | B. | 硫酸鈉溶液 | C. | H2O2溶液 | D. | 氯水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
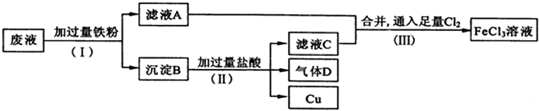
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
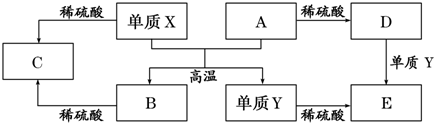
| A. | 單質Y在一定條件下能與水發生置換反應 | |
| B. | 向D溶液中滴加KSCN溶液,產生血紅色沉淀 | |
| C. | X與A反應的化學方程式是 Al2O3+2Fe$\frac{\underline{\;高溫\;}}{\;}$Fe2O3+2Al | |
| D. | 由于氧化物A和B均能與酸反應所以均是堿性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com