
 Cl2、ClO2等氣體可作為水處理等方面有廣泛應用的高效安全消毒劑.我國從2 000年起逐步用ClO2代替氯氣對飲用水進行消毒.
Cl2、ClO2等氣體可作為水處理等方面有廣泛應用的高效安全消毒劑.我國從2 000年起逐步用ClO2代替氯氣對飲用水進行消毒.分析 (1)利用氯氣與消石灰反應制備漂白粉,反應生成氯化鈣、次氯酸鈣與水;
(2)反應中Fe、Mn元素化合價升高,被氧化;
(3)工業上在80℃時電解氯化鈉溶液得到 NaClO3,氯離子發生氧化反應得到ClO3-,根據O元素守恒,可知有水參加反應,根據電荷守恒可知有氫離子生成;
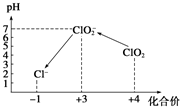
(4)①ClO2具有氧化性,加入淀粉后溶液變藍,說明I-被氧化性I2,由圖可知中性條件下生成ClO2-,配平書寫離子方程式;
②加入最后一滴Na2S2O3溶液時,碘反應完畢,溶液藍色褪去;
③由圖可知,酸性條件下ClO2-具有氧化性,將I-被氧化性I2,自身被還原為Cl-;
④根據電子轉移守恒、2S2O32-+I2═S4O62-+2I-,可知關系式:2ClO2~I2~2S2O32-,結合關系式計算.
解答 解:(1)利用氯氣與消石灰反應制備漂白粉,反應生成氯化鈣、次氯酸鈣與水,反應方程式為:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案為:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(2)反應中Fe、Mn元素化合價升高,被氧化,說明ClO2具有氧化性,
故答案為:氧化性;
(3)工業上在80℃時電解氯化鈉溶液得到 NaClO3,氯離子發生氧化反應得到ClO3-,根據O元素守恒,可知有水參加反應,根據電荷守恒可知有氫離子生成,電極反應式為:Cl-+3H2O-6e-=ClO3-+6H+,
故答案為:Cl-+3H2O-6e-=ClO3-+6H+;
(4)①ClO2具有氧化性,加入淀粉后溶液變藍,說明I-被氧化性I2,由圖可知中性條件下生成ClO2-,反應離子方程式為:2ClO2+2I-=I2+2ClO2-,
故答案為:2ClO2+2I-=I2+2ClO2-;
②加入最后一滴Na2S2O3溶液時,溶液藍色褪去,且半分鐘內不恢復原色,說明滴定到終點,
故答案為:溶液藍色褪去,且半分鐘內不恢復原色;
③由圖可知,酸性條件下ClO2-具有氧化性,將I-被氧化性I2,自身被還原為Cl-,反應離子方程式為:ClO2-+4I-+4H+=2I2+Cl-+2H2O,
故答案為:ClO2-+4I-+4H+=2I2+Cl-+2H2O;
④設1L水樣中ClO2為xg,則:
2ClO2~~I2~~2S2O32-,
135g 2mol
xg 1.0×10-3 mol/L×0.01mL
所以135g:xg=2mol:1.0×10-3 mol/L×0.01mL
解答x=6.75×10-4
則水樣中ClO2的濃度是0.675mg/L
故答案為:0.675.
點評 本題考查氧化還原反應基本概念、氧化還原方程式書寫、氧化還原反應滴定等,注意根據不同pH環境與粒子種類關系圖判斷發生的反應,是對學生綜合能力的考查,難度中等.


科目:高中化學 來源: 題型:解答題
| 元素 | Mn | Fe | |
| 電離能 | I1 | 717 | 759 |
| (kJ•mol-1) | I2 | 1 509 | 1 561 |
| I3 | 3 248 | 2 957 | |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硼(B)、鋁(Al)、鎵(Ga)均屬于硼族元素(第ⅢA族),它們的化合物或單質都有重要用途.回答下列問題:
硼(B)、鋁(Al)、鎵(Ga)均屬于硼族元素(第ⅢA族),它們的化合物或單質都有重要用途.回答下列問題: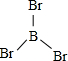 三溴化磷
三溴化磷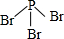
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
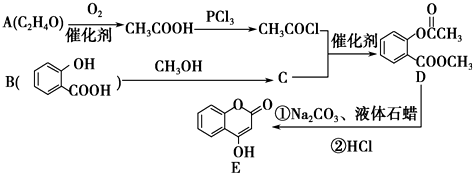
 +2NaOH $\stackrel{△}{→}$
+2NaOH $\stackrel{△}{→}$  +H2O.
+H2O. 是一種重要的有機合成中間體.
是一種重要的有機合成中間體. ;②光照時,甲苯與Cl2側鏈取代.
;②光照時,甲苯與Cl2側鏈取代.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
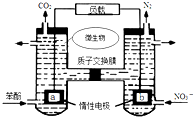
| A. | a電極發生還原反應 | |
| B. | H+由右室通過質子交換膜進入左室 | |
| C. | b電極反應式為:2NO3-+10e-+12H+═N2↑+6H2O | |
| D. | 電池工作時,電流由a電極沿導線流向b電極 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放電時,OH-向負極方向移動 | |
| B. | 放電時,正極反應式為Zn+2OH--2e-═ZnO+H2O | |
| C. | 充電時,Zn發生氧化反應 | |
| D. | 充電時,陰極附近PH 減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗操作步驟 | 預期現象與結論 |
| 步驟1:觀察樣品 | 溶液呈藍綠色,①不能(填“能”或“不能”)確定產物中鐵元素的價態 |
| 步驟2: 取少量溶液,滴加酸性KMnO4溶液 | ②若KMnO4溶液的紫紅色褪去或變淺,說明產物中含+2價鐵元素,若KMnO4溶液不褪色或紅色不變淺,說明產物中不含+2價鐵元素 |
| 步驟3:③另取少量溶液,滴加KSCN溶液 | 若溶液變為紅色,說明產物中含+3價的鐵元素;若溶液顏色無明顯變化,則說明產物中不含+3價的鐵元素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com