
【題目】按要求回答下列問題
(1)質子數為17、中子數為20的原子可表示為________,Na+的結構示意圖________。
(2)焰色反應是_______變化,將碳酸鈉進行焰色反應,火焰呈________。
(3)漂白粉有效成分的化學式________,漂白粉發揮漂白作用的反應方程式________。
【答案】![]()
![]() 物理 黃色 Ca(ClO)2 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
物理 黃色 Ca(ClO)2 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
【解析】
(1)根據原子符號中各個角標的含義書寫;Na+是Na原子失去最外層的1個電子后形成的;
(2)焰色反應是原子核外電子發生能量躍遷時的結果,Na元素焰色反應呈黃色;
(3)漂白粉是氯氣與石灰乳反應產生,其有效成分是次氯酸鈣,漂白時次氯酸鈣與CO2、H2O反應產生HClO。
(1)在原子表示中,在元素符號左下角為質子數,左上角為質量數,等于質子數與中子數的和,該原子質子數為17,是Cl元素的原子,中子數為20,則其質量數為17+20=37,該原子可表示為![]() ;Na是11號元素,Na原子失去最外層的1個電子形成Na+,其結構示意圖為:
;Na是11號元素,Na原子失去最外層的1個電子形成Na+,其結構示意圖為:![]() ;
;
(2)當金屬或其化合物灼燒時,電子由能量較低的基態躍遷到能量較高的激發態,電子處于激發態時,不穩定,多余的能量以光的形式釋放出來,因此在發生焰色反應是時沒有新物質生成,發生的是物理變化;將碳酸鈉進行焰色反應,由于含有Na元素,所以火焰呈黃色;
(3)漂白粉是氯氣與石灰乳反應產生,其成分是CaCl2、Ca(ClO)2,有效成分是次氯酸鈣,漂白粉發揮漂白作用時,其中含有的次氯酸鈣與CO2、H2O反應產生HClO,反應方程式為:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO。


 新課標同步訓練系列答案
新課標同步訓練系列答案 一線名師口算應用題天天練一本全系列答案
一線名師口算應用題天天練一本全系列答案科目:高中化學 來源: 題型:
【題目】鋁是地殼中含量最多的金屬元素,它性能穩定,供應充足,鋁—空氣電池具有能量密度高、工作原理簡單、成本低、無污染等優點。鋁—空氣電池工作原理示意圖如圖:
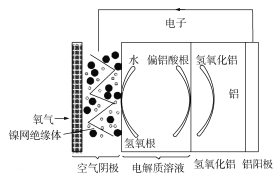
下列說法錯誤的是
A. 若是堿性電解質溶液中,則電池反應的離子方程式為:4Al+3O2+6H2O+4OH=4Al(OH)4-
B. 若是中性電解質溶液中,則電池反應的方程式為:4Al+3O2+6H2O=4Al(OH)3
C. 如果鋁電極純度不高,在堿性電解質溶液中會產生氫氣
D. 若用該電池電解氯化鈉溶液(石墨作電極),當負極減少5.4g時,陽極產生6.72L氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫度下,將Cl2緩慢通入水中至飽和,然后再滴加0.1mol/L的NaOH溶液,整個過程中溶液的pH變化曲線如圖所示。下列選項正確的是
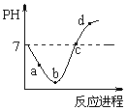
A. a點時,已經滴入NaOH溶液
B. b點所示的溶液中,只存在兩種分子
C. a、b、c、d四個點中,c點水的電離程度最大
D. d點所示的溶液中,鈉元素與氯元素的物質的量相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電導率可用于衡量電解質溶液導電能力的大小。向一定濃度的![]() 溶液中滴入某濃度的
溶液中滴入某濃度的![]() 溶液,其電導率隨滴入的
溶液,其電導率隨滴入的![]() 溶液體積的變化如圖所示。下列說法不正確的是( )
溶液體積的變化如圖所示。下列說法不正確的是( )
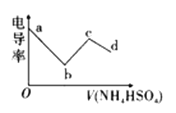
A. bc段的離子方程式為:![]()
B. c點溶液中:![]()
C. bc段之間存在某點,其溶液中:![]()
D. b點溶液存在三個平衡,且水的電離被抑制
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的有( )
①需要通電才可以進行的有:電解、電離、電鍍、電泳②水玻璃、福爾馬林、天然橡膠、鋁熱劑都是混合物③![]() 、
、![]() 、
、![]() 均可由化合反應制得④油脂、淀粉、纖維素、天然橡膠都是天然有機高分子化合物⑤“血液透析”和“靜電除塵”利用了膠體的同一種性質⑥
均可由化合反應制得④油脂、淀粉、纖維素、天然橡膠都是天然有機高分子化合物⑤“血液透析”和“靜電除塵”利用了膠體的同一種性質⑥![]() 、
、![]() 分子中的碳原子均共面⑦鉛蓄電池放電結束后,正極電極板的質量在減小
分子中的碳原子均共面⑦鉛蓄電池放電結束后,正極電極板的質量在減小
A. 2個B. 3個C. 4個D. 5個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z是第ⅠA~ⅦA族的三種非金屬元素,它們在元素周期表中的位置如圖所示,試回答下列問題。
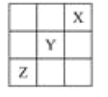
(1)X元素單質的化學式是________。
(2)Y元素的原子結構示意圖是____________,Y與Na所形成化合物的電子式為________________________。
(3)Z元素的名稱是________,從元素原子得失電子的角度看,Z元素具有________性;若從Z元素在元素周期表中所處位置看,它具有這種性質的原因是_________________________,其價電子排布式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ:已知亞磷酸![]() 是具有強還原性的二元弱酸,可被銀離子氧化為磷酸。
是具有強還原性的二元弱酸,可被銀離子氧化為磷酸。
(1)亞磷酸與銀離子反應的離子方程式為_______________________。
(2)向亞磷酸溶液中滴加氫氧化鈉溶液至中性,寫出所得溶液中電荷守恒方程式_________________。
(3)某溫度下,![]() 的亞磷酸溶液的pH為1.4,即
的亞磷酸溶液的pH為1.4,即![]() ,則該溫度下亞磷酸的一級電離平衡常數
,則該溫度下亞磷酸的一級電離平衡常數![]() _________。(亞磷酸第二級電離忽略不計,結果保留兩位有效數字)
_________。(亞磷酸第二級電離忽略不計,結果保留兩位有效數字)
Ⅱ:焦亞硫酸鈉![]() 在醫藥、印染、食品等方面應用廣泛,也可作為食品的抗氧化劑。
在醫藥、印染、食品等方面應用廣泛,也可作為食品的抗氧化劑。
(4)工業上制備焦亞硫酸鈉![]() 常用
常用![]() 與碳酸鈉溶液的反應,當
與碳酸鈉溶液的反應,當![]() 加過量直至過飽和時,溶液中就會析出焦亞硫酸鈉的晶體,寫出該反應的化學方程式:__________________________。
加過量直至過飽和時,溶液中就會析出焦亞硫酸鈉的晶體,寫出該反應的化學方程式:__________________________。
(5)由于![]() 具有毒性,因此國家對其在食品中的用量有嚴格的規定。某化學興趣小組在測定某白葡萄酒中
具有毒性,因此國家對其在食品中的用量有嚴格的規定。某化學興趣小組在測定某白葡萄酒中![]() 的殘留量時,取40mL葡萄酒樣品,用
的殘留量時,取40mL葡萄酒樣品,用![]() 的含有淀粉的碘的標準溶液滴定至終點,消耗碘標準溶液5mL,則滴定終點的現象為_________________,該樣品中
的含有淀粉的碘的標準溶液滴定至終點,消耗碘標準溶液5mL,則滴定終點的現象為_________________,該樣品中![]() 的殘留量為___________
的殘留量為___________ ![]() (以
(以![]() 計)。
計)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用![]() 與
與![]() 反應制備KI固體,裝置如圖所示。實驗步驟:①檢查裝置的氣密性;②關閉K,在各裝置中加入相應試劑,向裝置B中滴入30%的KOH溶液,制得
反應制備KI固體,裝置如圖所示。實驗步驟:①檢查裝置的氣密性;②關閉K,在各裝置中加入相應試劑,向裝置B中滴入30%的KOH溶液,制得![]() ;③打開K,通入
;③打開K,通入![]() 直至飽和可制得KI,同時有黃色沉淀生成;④關閉K,向所得溶液滴入稀硫酸,水浴加熱,充分逸出
直至飽和可制得KI,同時有黃色沉淀生成;④關閉K,向所得溶液滴入稀硫酸,水浴加熱,充分逸出![]() ;⑤把裝置B中混合液倒入燒杯,為除去硫酸,加入足量碳酸鋇,再經過一系列操作可得成品。下列有關該實驗的敘述錯誤的是( )
;⑤把裝置B中混合液倒入燒杯,為除去硫酸,加入足量碳酸鋇,再經過一系列操作可得成品。下列有關該實驗的敘述錯誤的是( )
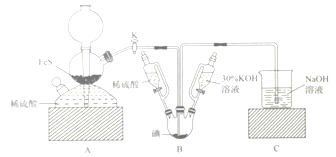
A. 步驟②可觀察到固體溶解,溶液由棕黃色變為無色
B. 步驟③裝置B中發生反應的離子方程式為![]()
C. 裝置C中氫氧化鈉溶液的作用是吸收硫化氫
D. 步驟⑤中一系列操作為過濾,洗滌,合并濾液和洗液,蒸餾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某廠廢水中含5.00×10-3mol·L-1的![]() ,其毒性較大。某研究性學習小組為了變廢為寶,將廢水處理得到磁性材料
,其毒性較大。某研究性學習小組為了變廢為寶,將廢水處理得到磁性材料![]() (
(![]() 的化合價依次為+3、+2),設計了如下實驗流程:
的化合價依次為+3、+2),設計了如下實驗流程:
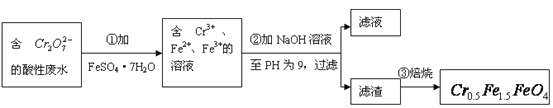
(1)第①步反應的離子方程式是_________________________________________________;
(2)第②步中用pH試紙測定溶液pH的操作是:
______________________________________________________________________________;
(3)第②步過濾得到的濾渣中主要成分除Cr(OH)3外,還有______________________;
(4)欲使1L該廢水中的![]() 完全轉化為
完全轉化為![]() 。理論上需要加入__________g FeSO4·7H2O。
。理論上需要加入__________g FeSO4·7H2O。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com