甲醇是一種很好的燃料,工業上可用多種原料通過不同的反應制得甲醇.
(1)已知在常溫常壓下:
CH
3OH(l)+O
2(g)=CO(g)+2H
20(l)△H=-442.8kJ?mol
-12CO(g)+O
2(g)=2CO
2(g)△H=-556.0kJ?mol
-1H
2O(g)=H
2O(l)△H=-44.0kJ?mol
-1 則2CH
3OH(l)+3O
2(g)=2CO
2(g)+4H
2O(g)△H=
kJ?mol
-1(2)工業上正在研究利用來生產甲醇燃料的方法,該反應為:
CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)△H=-49.0kJ?mol
-1在某溫度下,將6mol CO
2和8mol H
2充入容積為2L的密閉容器中,8分鐘時達平衡狀態,H
2的轉化率為75%.請回答:
①用CH
3OH表示該反應在0-8min內的平均反應速率v(CH
3OH)=
.
②此溫度下該反應平衡常數K=
L
2?mol
-2;
③若在上述平衡體系中,再充入2mol H
2,反應達到平衡后的轉化率
75%(填“大于”、“小于”或“等于”).
(3)一氧化碳與氫氣也可以合成甲醇:CO(g)+2H
2(g)?CH
3OH(g)△H<0
①若該反應在恒溫恒容條件下進行,下列說法正確的是
;
a.若混合氣體的密度不再改變,說明反應已達化學平衡狀態
b.反應達到平衡后,通入CH
3OH(g)使壓強增大,平衡向右移動
c.反應達到平衡后,通入氬氣使壓強增大,平衡向右移動
d.反應達到平衡后,升高溫度,平衡逆向移動,平衡常數減小
e.若使用催化劑,會改變反應的途徑,但反應的不變
②某溫度下,在一個容積為2L的密閉容器中進行該反應,已知此溫度下的平衡常數K=50L
2?mol
-2,反應到某時刻測得各組分的物質的量如下:
| 物質 | CO | H2 | CH3OH |
| 物質的量/(mol) | 0.4 | 0.4 | 0.8 |
請比較此時正、逆反應速率的大小:v
正
v
逆(填“>”、“<”或“=”).



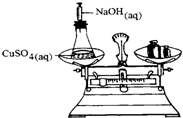 將一密閉的化學反應裝置在天平上稱量(如圖所示).當在溶液中注入氫氧化鈉溶液之后,下列敘述正確的是( )
將一密閉的化學反應裝置在天平上稱量(如圖所示).當在溶液中注入氫氧化鈉溶液之后,下列敘述正確的是( )