
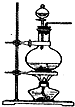
 化學實驗有助于理解化學知識,提升科學素養.某學習小組在實驗室中用濃鹽酸與MnO2共熱制取Cl2并進行相關探究.
化學實驗有助于理解化學知識,提升科學素養.某學習小組在實驗室中用濃鹽酸與MnO2共熱制取Cl2并進行相關探究.分析 (1)濃鹽酸與MnO2共熱反應生成氯化錳、氯氣和水;
檢查氣密性后先向燒瓶中加入二氧化錳再用分液漏斗加入濃鹽酸加熱反應制取氯氣;
(2)濃鹽酸易揮發,從發生裝置中制取的氯氣含有氯化氫、水蒸汽雜質,要制取純凈干燥的氯氣應分別除去氯化氫和水蒸氣;
(3)依據方程式:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知只有濃鹽酸才能與二氧化錳反應,鹽酸定量時隨著反應進行鹽酸濃度降低,變為稀鹽酸,不再與二氧化錳反應;
(4)工業上用電解飽和食鹽水方法制取氯氣.
解答 解:(1)濃鹽酸與MnO2共熱反應生成氯化錳、氯氣和水,化學方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2 H2O;
檢查氣密性后先向燒瓶中加入二氧化錳再用分液漏斗加入濃鹽酸加熱反應制取氯氣,所以正確的順序為:ACB;
故答案為:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2 H2O; A C B;
(2)濃鹽酸易揮發,從發生裝置中制取的氯氣含有氯化氫、水蒸汽雜質,通過盛有飽和食鹽水的洗氣瓶可以除去氯化氫氣體,通過盛有濃硫酸的洗氣瓶可以除去水蒸氣;
故答案為:飽和食鹽水;濃硫酸;
(3)依據方程式:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知只有濃鹽酸才能與二氧化錳反應,鹽酸定量時隨著反應進行鹽酸濃度降低,變為稀鹽酸,不再與二氧化錳反應,
A.若提供0.4mol HCl,MnO2不足量,鹽酸在反應過程中濃度降低,變為稀鹽酸,不再反應,故得氯氣小于2.24L,故A不選;
B.若提供0.4mol HCl,MnO2過量,鹽酸在反應過程中濃度降低,變為稀鹽酸,不再反應,故得氯氣小于2.24L,故B不選;
C.若有0.4mol HCl參與反應,依據方程式:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成氯氣0.1mol,則可制得氯氣2.24L,故C選;
D.依據方程式:MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,若有0.4mol HCl被氧化,生成0.2mol氯氣,則可制得氯氣4.48L,故D不選;
故選:C;
(4)工業上用電解飽和食鹽水制取氯氣,方程式:2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案為:2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑.
點評 本題考查了實驗室、工業制備氯氣的原理,明確反應原理是解題關鍵,注意氯氣的凈化,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 人工牛胰島素的合成,標志著人類在化學合成技術上邁出了重要的一步 | |
| B. | 牛胰島素的水溶液可產生丁達爾效應 | |
| C. | 結晶牛胰島素合成之前,應先確定每條鏈上氨基酸的排列順序 | |
| D. | 結晶牛胰島素雙鏈之間通過肽鍵聯接 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
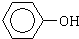 ②CH2=CH2③CH≡CH ④
②CH2=CH2③CH≡CH ④ ⑤
⑤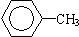 ⑥
⑥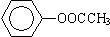 ⑦CH3CH2CH2CH2Br
⑦CH3CH2CH2CH2Br查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
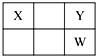 X、Y、Z、W、Q是原子序數依次增大的五種短周期主族元素.其中Z是金屬,W的單質是淡黃色固體,X、Y、W在周期表中的相對位置關系如圖所示,下列說法一定正確的是( )
X、Y、Z、W、Q是原子序數依次增大的五種短周期主族元素.其中Z是金屬,W的單質是淡黃色固體,X、Y、W在周期表中的相對位置關系如圖所示,下列說法一定正確的是( )| A. | 最高價氧化物對應水化物的酸性最強的是W | |
| B. | Y與Z只能形成一種化合物 | |
| C. | 簡單陰離子還原性:Y>W | |
| D. | Z與Q形成的化合物可能含共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
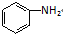 )、水楊酸(
)、水楊酸(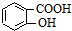 )、硝基苯與苯酚四種有機物的乙醚溶液,按如下流程利用物質的酸堿性依次分離,假設每一步分離都是完全的.(已知苯胺是一種難溶于水,具有弱堿性的有機物.)
)、硝基苯與苯酚四種有機物的乙醚溶液,按如下流程利用物質的酸堿性依次分離,假設每一步分離都是完全的.(已知苯胺是一種難溶于水,具有弱堿性的有機物.)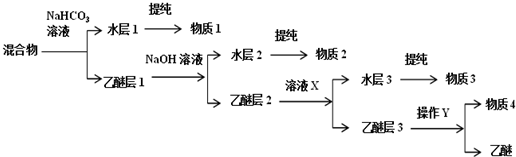
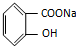 ,物質3的分子式為C6H7N.
,物質3的分子式為C6H7N. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 對應氣態氫化物的穩定性M>R | B. | R元素的最高正價一定為+7價 | ||
| C. | 離子半徑:M2->R->N2+ | D. | 還原性:M2-<R- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
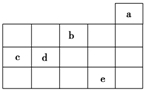 如圖為周期表前4周期的一部分,其中五種元素a、b、c、d、e的位置如圖所示,
如圖為周期表前4周期的一部分,其中五種元素a、b、c、d、e的位置如圖所示,| A. | b元素除0價外,只有一種化合價 | |
| B. | a元素形成的單質最穩定,分子式為a3 | |
| C. | c、d元素的原子半徑:c<d | |
| D. | e元素在自然界中主要存在于海水中,被稱為“海洋元素” |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com