
| Fe3+ | Fe2+ | Cu2+ | |
| 氫氧化物開始沉淀時的pH | 1.9 | 7.0 | 4.7 |
| 氫氧化物沉淀完全時的pH | 3.2 | 9.0 | 6.7 |
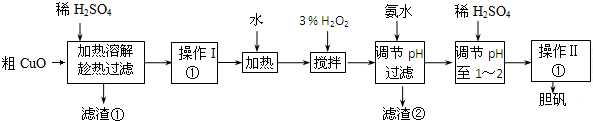
分析 在粗CuO中加入硫酸生成硫酸銅、硫酸鐵、硫酸亞鐵等物質,經操作I得到粗膽礬,然后加入過氧化氫,將亞鐵離子氧化為鐵離子,使之在銅離子之前沉淀,加氨水調節pH值目的是讓三價鐵離子沉淀,但是銅離子不沉淀,然后調節溶液pH1~2之間可得到純凈的硫酸銅溶液,經蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,可以得到膽礬晶體.
(1)氧化銅和硫酸反應生成硫酸銅和水,濾渣②的成分是氫氧化鐵;
(2)雙氧水具有氧化性,在加熱條件下會發生分解反應生成水以及氧氣;過氧化氫與Fe2+發生氧化還原反應;
(3)調節pH的范圍應使Fe3+完全沉淀而Cu2+不生成沉淀,由表中數據可知應調節pH介于3.2~4.7之間;
(4)根據溶液得到晶體的方法:蒸發濃縮、冷卻結晶、過濾,洗滌、干燥,洗滌洗去表面的雜質離子.
解答 解:(1)氧化銅和硫酸反應CuO+H2SO4=CuSO4+H2O,離子反應為:CuO+2H+=Cu2++H2O,在粗CuO中加入硫酸生成硫酸銅、硫酸鐵、硫酸亞鐵等物質,經操作I得到粗膽礬,然后加入過氧化氫,將亞鐵離子氧化為鐵離子,使之在銅離子之前沉淀,加氨水調節pH值目的是讓三價鐵離子沉淀,但是銅離子不沉淀,所以濾渣②的成分是氫氧化鐵,
故答案為:CuO+2H+=Cu2++H2O;Fe(OH)3;
(2)雙氧水具有氧化性,可以將亞鐵離子氧化為鐵離子,在加熱條件下雙氧水會發生分解反應生成水以及氧氣,過氧化氫與Fe2+發生氧化還原反應,反應的離子方程式為2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案為:防止雙氧水分解;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)根據流程和目的,加氨水調節pH值目的是讓三價鐵離子沉淀,但是銅離子不沉淀,根據表中的數據,三價鐵離子沉淀完全的pH是3.2,銅離子開始沉淀的pH為4.7,所以調節的pH范圍是3.2~4.7,
故答案為:3.2~4.7;
(4)經操作Ⅰ得到粗膽礬,經操作Ⅱ得到精制膽礬,兩步操作都包括蒸發濃縮、冷卻結晶、過濾、洗滌、干燥等步驟,其中“洗滌”的目的是洗去表面的雜質離子,如銨根離子,
故答案為:蒸發濃縮、冷卻結晶;洗去表面的雜質離子.
點評 本題考查物質的制備實驗方案的設計,側重于學生的分析能力、實驗能力和計算能力的考查,為高考常見題型,注意根據流程圖把握實驗的原理和物質分離提純的操作方法,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 甲 | 乙 |
| A | 干燥劑 | 濃硫酸、石灰石、無水氯化鈣 |
| B | 電解質 | 冰醋酸、鋁、水 |
| C | 酸性氧化物 | 二氧化碳、二氧化硫、三氧化硫 |
| D | 堿性氧化物 | 三氧化鐵、氧化鈉、氧化鋁 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H4O | B. | C2H5OH | C. | CH3CHO | D. | CH3COOH |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
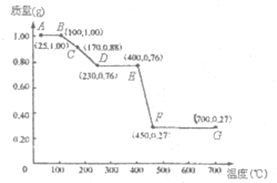 如圖是1.00g MgC2O4•nH2O晶體放在坩堝里從25℃徐徐加熱至700℃時,所得同體產物的質量(m)隨溫度(t)變化的關系曲線.(已知100℃以上才會逐漸失去結晶水,并約在230℃時完全失去結晶水)
如圖是1.00g MgC2O4•nH2O晶體放在坩堝里從25℃徐徐加熱至700℃時,所得同體產物的質量(m)隨溫度(t)變化的關系曲線.(已知100℃以上才會逐漸失去結晶水,并約在230℃時完全失去結晶水)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用惰性電極電解飽和食鹽水時,陽極的電極反應式為:2Cl--2e-═Cl2↑ | |
| B. | 向沸水中滴加FeCl3飽和溶液制備Fe(OH)3膠體:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 粗銅精煉時,與電源正極相連的是純銅,正極反應式為:Cu-2e-═Cu2+ | |
| D. | NaHS水解:HS-+H2O?H3O++S2- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com