
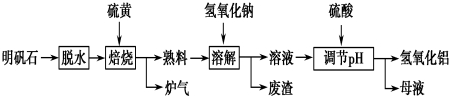
分析 根據元素守恒和得失電子守恒,可知焙燒爐中發生反應的化學方程式為2Al2(SO4)3+3S$\frac{\underline{\;高溫\;}}{\;}$2Al2O3+9SO2,故生成爐氣中含二氧化硫,熟料中含氧化鋁、氧化鐵、硫酸鉀等,加入氫氧化鈉和水,氧化鋁和氫氧化鈉反應生成偏鋁酸鈉,氧化鐵不反應,過濾,濾渣中含氧化鐵,濾液中含偏鋁酸鈉和硫酸鉀、氫氧化鈉等;用硫酸調節pH,得到氫氧化鋁沉淀和硫酸鈉、硫酸鉀,過濾得母液中含硫酸鉀、硫酸鈉溶質.
(1)根據元素守恒和得失電子守恒,硫酸鋁和硫單質發生的是氧化還原反應,氧化產物和含有產物為二氧化硫,可知焙燒爐中發生反應的化學方程式為2Al2(SO4)3+3S$\frac{\underline{\;高溫\;}}{\;}$2Al2O3+9SO2;
(2)分離溶液和廢渣的操作用過濾,氫氧化鈉與氧化鋁反應生成偏鋁酸鈉和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根離子,通過檢驗硫酸根離子的方法進行實驗;
(4)“母液”中含有硫酸鹽;
(5)依據化學方程式中定量關系確定明礬石的主要成分為K2SO4•Al2(SO4)3•2Al2O3•6H2O物質的量,結合鋁元素守恒計算得到氫氧化鋁的理論值.
解答 解:根據元素守恒和得失電子守恒,硫酸鋁和硫單質發生的是氧化還原反應,氧化產物和含有產物為二氧化硫,可知焙燒爐中發生反應,故生成爐氣中含二氧化硫,熟料中含氧化鋁、氧化鐵、硫酸鉀等,加入氫氧化鈉和水,氧化鋁和氫氧化鈉反應生成偏鋁酸鈉,氧化鐵不反應,過濾,濾渣中含氧化鐵,濾液中含偏鋁酸鈉和硫酸鉀、氫氧化鈉等;用硫酸調節pH,得到氫氧化鋁沉淀和硫酸鈉、硫酸鉀,過濾得母液中含硫酸鉀、硫酸鈉溶質,
(1)硫酸鋁和硫單質發生的是氧化還原反應,氧化產物和含有產物為二氧化硫,反應中硫元素化合價由Al2(SO4)3中S元素的+6價降低,單質硫中S的化合價升高,令產物中S的化合價為+x價,根據得失電子守恒可知6(6-x)=3(x-0),則x=4,所以生成產物為SO2,則反應的化學方程式為2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,
故答案為:2,3,2,9SO2;
(2)分離溶液和廢渣的操作用過濾,氫氧化鈉與氧化鋁反應生成偏鋁酸鈉和水,反應的離子方程式為Al2O3+2OH-=2AlO2-+H2O,
故答案為:過濾,Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根離子,通過檢驗硫酸根離子的方法進行實驗,方法為取最后一次洗滌的流出液于試管中,滴加BaCl2溶液,若無白色沉淀生成則已洗滌干凈,
故答案為:取最后一次洗滌的流出液于試管中,滴加BaCl2溶液,若無白色沉淀生成則已洗滌干凈;
(4)根據流程分析可知“母液”中含有硫酸鹽中含有K2SO4、Na2SO4,都可回收利用,
故答案為:K2SO4;Na2SO4;
(6)氫氧化鋁具有兩性,能與硫酸反應,不嚴格控制pH值,會導致氫氧化鋁溶解,從而得不到氫氧化鋁沉淀,故答案為:氫氧化鋁具有兩性,能與硫酸反應,不嚴格控制pH值,會導致氫氧化鋁溶解,從而得不到氫氧化鋁沉淀;
(5)2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,依據鋁元素守恒計算,若“焙燒”過程中恰好消耗48g硫黃物質的量=$\frac{48g}{32g/mol}$=1.5mol,反應的2Al2(SO4)3物質的量為1mol,K2SO4•Al2(SO4)3•2Al2O3•6H2O物質的量為1mol,
K2SO4•Al2(SO4)3•2Al2O3•6H2O~6Al(OH)3,
1 6×78
1mol m
則理論上最終可得到m=468g
故答案為:468.
點評 本題考查物質的制備、分離等知識,側重于學生的分析能力和實驗能力的考查,為高考常見題型,題目難度中等,注意把握物質的相關性質.


 黎明文化寒假作業系列答案
黎明文化寒假作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 181kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氟化氫氣體分解生成氫氣和氟氣的反應是放熱反應 | |
| B. | 1 mol H2與1 mol F2反應生成2 mol液態HF放出的熱量小于270kJ | |
| C. | 在相同條件下,1 mol H2與1 mol F2的能量總和大于2 mol HF氣體的能量 | |
| D. | 放熱反應的反應速率總是大于吸熱反應的反應速率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碘酒是指碘單質的乙醇溶液 | |
| B. | 濃硫酸可以刻蝕石英制藝術品 | |
| C. | 84消毒液的有效成分是NaClO | |
| D. | 氫氧化鋁、小蘇打等可用于治療胃酸過多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com