
| A. | 硅、鍺都位于金屬與非金屬的交界處,都可以做半導體材料 | |
| B. | 氫化物的沸點:H2O>NH3>HF | |
| C. | 同主族元素從上到下,單質的熔點逐漸降低 | |
| D. | P的非金屬性強于Si,H3PO4比H2SiO3的酸性強 |
分析 A、位于金屬與非金屬的交界處的元素具有半導體的性質;
B、根據范德華力對物質性質的影響結合H2O、NH3、HF中含有氫鍵分析;
C、根據鹵族元素自上而下單質熔沸點升高,堿金屬自上而下單質熔沸點降低;
D、非金屬性越強最高價氧化物對應水化物的酸性越強.
解答 解:A、位于金屬與非金屬的交界處的元素具有半導體的性質,硅、鍺都位于金屬與非金屬的交界處,都可以做半導體材料,故A正確;
B、組成和結構相似的分子,相對分子質量越大,分子間作用力越強,物質的熔沸點越高,H2O、NH3、HF屬于分子晶體,但H2O、NH3、HF中都含有氫鍵,使得沸點變大,每個H2O中含有2個氫鍵,每個NH3中含有1個氫鍵,每個HF中含有1個氫鍵,且氟的非金屬性強于氮,所以氫化物的沸點:H2O>HF>NH3,故B錯誤;
C、鹵族元素自上而下單質熔沸點升高,堿金屬自上而下單質熔沸點降低,所以同主族元素的單質的熔點從上到下不一定逐漸降低,故C錯誤;
D、非金屬性越強最高價氧化物對應水化物的酸性越強,P的非金屬性強于Si,所以H3PO4比H2SiO3的酸性強,故D正確;
故選AD.
點評 本題考查同周期元素性質遞變規律和差異性,比較基礎,注意從原子結構理解金屬性、非金屬性遞變規律.


科目:高中化學 來源: 題型:選擇題
| A. | 青蒿素的一個分子中含有42個原子 | |
| B. | 青蒿素屬于無機物 | |
| C. | 青蒿素的相對分子質量為282 | |
| D. | 青蒿素中碳元素的質量分數約為63.8% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化還原反應的本質是元素化合價發生了改變 | |
| B. | 失電子的物質被還原 | |
| C. | 某元素從化合物狀態變成單質狀態,該元素一定被還原 | |
| D. | 氧化還原反應中,氧化劑和還原劑可能是同一種物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 實驗現象 | 結論 |
| A | 向FeBr2溶液中通入少量Cl2 | 溶液由淺綠色變為黃色 | 氧化性:Cl2>Br2 |
| B | 向Na2SO3溶液中滴加鹽酸 | 有氣體產生 | 非金屬性:Cl>S |
| C | 向pH=3的HA和HB溶液中分別加水稀釋至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
| D | 向重晶石中加入飽和碳酸鈉溶液 | 重晶石逐漸溶解 | 溶度積:Ksp(BaCO3)<Ksp(BaSO4) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
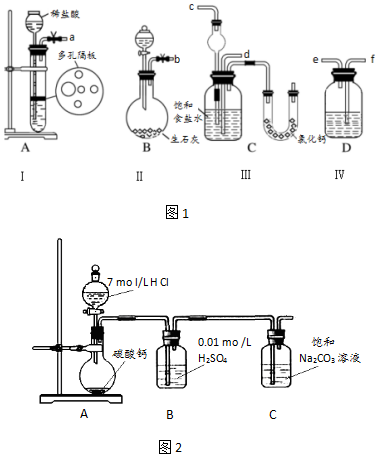
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將Cl2通入氯化亞鐵溶液 Fe2++Cl2=Fe3++2Cl- | |
| B. | 向FeBr2溶液中通入足量氯氣:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl | |
| C. | 少量Ca(HCO3)2溶液與過量NaOH溶液反應:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 銅與濃硝酸的反應:Cu+4HNO3=Cu 2++NO3-+2NO2↑+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 我國目前使用的主要能源仍是化石燃料,它屬于不可再生能源 | |
| B. | 太陽能、氫能、風能、地熱能、生物質能、沼氣能等屬于新能源 | |
| C. | 解決能源危機的根本途徑是盡可能地節約能源,減少浪費 | |
| D. | 風能是太陽能的一種轉換形式,所以風能屬于二次能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
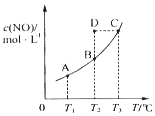 在一固定容積的密閉容器中,置入一定量的一氧化氮和足量碳發生化學反應:C(s)+2NO(g)?CO2(g)+N2(g),平衡時c (NO)與溫度T的關系如圖所示,則下列說法正確的是( )
在一固定容積的密閉容器中,置入一定量的一氧化氮和足量碳發生化學反應:C(s)+2NO(g)?CO2(g)+N2(g),平衡時c (NO)與溫度T的關系如圖所示,則下列說法正確的是( )| A. | 該反應的△H>0 | |
| B. | 若該反應在T1、T2時的平衡常數分別為K1、K2,則K1<K2 | |
| C. | 若狀態B、C、D的壓強分別為PB、PC、PD,則 PC=PD>PB | |
| D. | 在T2時,若 反 應 體 系 處于 狀 態D,則 此 時 v正>v逆 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com