
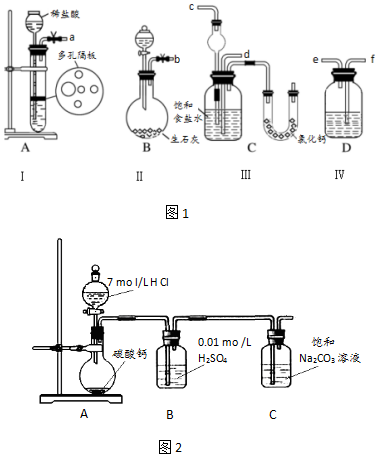
分析 (1)根據裝置A制取CO2,裝置B制取NH3,裝置D除去二氧化碳中的HCl,二氧化碳與氨氣通入C中,其中氨氣應防止倒吸,據此分析連接儀器裝置;
(2)A裝置是制備二氧化碳氣體一般用碳酸鈣和鹽酸反應生成,二氧化碳氣體中含有氯化氫氣體,會影響碳酸氫鈉的生成,D為裝置除雜可以用飽和碳酸氫鈉溶液;
(3)氨氣易溶于水,二氧化碳在水中的溶解度較小,制取碳酸氫鈉時先要得到含氨的飽和食鹽水;
(4)為了析出氯化銨晶體,則向濾液中加入適量的NaCl粉末,提高氯離子濃度,使NH4Cl晶體析出;實驗證明所得固體的成分大部分是氯化銨,是利用氯化銨的性質,受熱生成氯化氫和氨氣氣體,在試管口處溫度降低重新生成固體氯化銨分析判斷;
(5)B中酸可抑制二氧化碳的溶解,且能夠吸收二氧化碳中的氯化氫氣體;
(6)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液發生反應生成白色沉淀;
②樣液與BaCl2溶液混合,現白色沉淀并有氣體產生,沉淀為碳酸鋇、氣體為二氧化碳;
(7)氫氧化鈉與過量的二氧化碳反應生成碳酸氫鈉,也可以用碳酸鈉與二氧化碳反應生成碳酸氫鈉,據此寫出反應的化學方程式.
解答 解:(1)向飽和氯化鈉溶液中通入足量的二氧化碳與氨氣反應生成NaHCO3沉淀,則裝置A產生CO2,裝置B產生NH3,裝置D除去二氧化碳中的HCl,二氧化碳與氨氣通入C中,其中氨氣應防止倒吸,則b接c,故a接f、e接d,
故答案為:d、c;
(2)A裝置是制備二氧化碳氣體的反應,所以Ⅰ中盛放稀鹽酸的儀器名稱是長頸漏斗,生成的二氧化碳氣體中含有氯化氫,若不除去碳酸氫鈉難以形成,所以應用飽和碳酸氫鈉溶液或飽和氯化鈉溶液除去,
故答案為:長頸漏斗;飽和NaHCO3溶液;
(3)候氏制堿方法是利用氨氣溶解性大極易溶解于水,二氧化碳氣體水中溶解性較小,實驗飽和食鹽水中先通入氨氣,再通入二氧化碳氣體;實驗操作過程中,應讓B裝置先發生反應,
故答案為:B;
(4)第四步中為了析出氯化銨晶體,則向濾液中加入適量的NaCl粉末,提高氯離子濃度,使NH4Cl晶體析出;所得的氯化銨晶體中常含有少量的氯化鈉和碳酸氫鈉(約占5%~8%),設計簡單的實驗證明所得固體的成分大部分是氯化銨,是利用氯化銨的分解產物為氣體,溫度降低氨氣和氯化氫氣體會重新生成固體氯化氨,方法為:取少量樣品于試管中,用酒精燈加熱,看到試管上端有白煙生成(或試管口有白色晶體),最后剩余極少量的固體,從而證明所得固體的成分大部分是氯化銨;
故答案為:NaCl;取少量固體放入試管中,加熱,固體大部分消失,在試管口內壁又有較多的固體凝結;
(5)B中酸可抑制二氧化碳的溶解,則B中溶液的作用為CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在時,可使上述平衡向左移動,從而減少CO2在水中的溶解,同時吸收揮發出來的HCl氣體,
故答案為:CO2在水中存在平衡:CO2+H2O?H2CO3?HCO3-+H+,有H2SO4存在時,可使上述平衡向左移動,從而減少CO2在水中的溶解,同時吸收揮發出來的HCl氣體;
(6)①Na2CO3和NaHCO3都能跟Ca(OH)2溶液發生反應生成白色沉淀,所以無法確定固體的成分中是否含有NaHCO3,
故答案為:Na2CO3和NaHCO3都能跟Ca(OH)2溶液發生反應生成白色沉淀,無法確定固體的成分中是否含有NaHCO3;
②樣液與BaCl2溶液混合,現白色沉淀并有氣體產生,沉淀為碳酸鋇、氣體為二氧化碳,離子反應為2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;
故答案為:2HCO3-+Ba2+=BaCO3↓+CO2↑+H2O;
(7)可以將過量的CO2通入NaOH溶液或Na2CO3中,反應的化學方程式為:NaOH+CO2=NaHCO3或Na2CO3+CO2+H2O=2NaHCO3,
故答案為:NaOH+CO2=NaHCO3或Na2CO3+CO2+H2O=2NaHCO3.
點評 本題考查了純堿工業原理及其應用,題目難度中等,明確制備流程及常見物質的性質為解答關鍵,注意掌握侯氏制堿法的反應原理,試題側重考查學生的分析、理解能力及化學實驗能力.


科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使甲基橙變紅色的溶液:Mg2+、K+、SO42-、SO32- | |
| B. | 室溫下,由水電離出來的c(H+)=1×10-14mol•L-1的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞變紅色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 含大量NO3-的溶液:H+、Fe2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
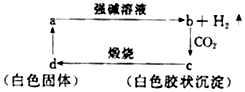
| A. | a在與強堿溶液的反應中氧化劑是強堿 | |
| B. | 向b中滴加適量鹽酸可得到c | |
| C. | c不一定是兩性物質 | |
| D. | d一定能和氫氧化鈉溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干冰、液態氯化氫都是電解質 | |
| B. | Na2O、Fe2O3、Al2O3既屬于堿性氧化物,又屬于離子化合物 | |
| C. | 硫酸、燒堿、純堿、生石灰分別屬于酸、堿、鹽、氧化物 | |
| D. | 根據是否具有丁達爾效應,將分散系分為溶液、濁液和膠體 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 硅、鍺都位于金屬與非金屬的交界處,都可以做半導體材料 | |
| B. | 氫化物的沸點:H2O>NH3>HF | |
| C. | 同主族元素從上到下,單質的熔點逐漸降低 | |
| D. | P的非金屬性強于Si,H3PO4比H2SiO3的酸性強 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬陽離子被還原時不一定得到金屬單質 | |
| B. | 非金屬元素的最高價含氧酸都具有強氧化性 | |
| C. | 由共價鍵形成的分子一定是共價化合物 | |
| D. | 直徑介于1nm~100nm之間的微粒成為膠體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com