
 .在工業上,用氯化鈉為原料,在堿性溶液中,通過電解的方法可制得NaClO,用離子方程式表示制取NaClO的電解總反應:Cl-+H2O$\frac{\underline{\;通電\;}}{\;}$ClO-+H2↑.將等濃度等體積的NaClO與Na2SO3溶液混合后,兩者恰好完全反應,寫出混合過程的離子反應方程式ClO-+SO32-=Cl-+SO42-.
.在工業上,用氯化鈉為原料,在堿性溶液中,通過電解的方法可制得NaClO,用離子方程式表示制取NaClO的電解總反應:Cl-+H2O$\frac{\underline{\;通電\;}}{\;}$ClO-+H2↑.將等濃度等體積的NaClO與Na2SO3溶液混合后,兩者恰好完全反應,寫出混合過程的離子反應方程式ClO-+SO32-=Cl-+SO42-.分析 (1)NaClO為離子化合物,具有強氧化性;用氯化鈉為原料,在堿性溶液中,通過電解的方法可制得NaClO,陽極生成NaClO,陰極生成氫氣;等濃度等體積的NaClO與Na2SO3溶液混合后,兩者恰好完全反應生成硫酸鈉和氯化鈉;
(2)燒瓶中加入飽和KAl(SO4)2溶液,次氯酸根離子水解顯堿性,鋁離子水解顯酸性,混合后水解相互促進,產生大量的白色膠狀沉淀和次氯酸;
次氯酸分解生成氯氣、氧氣和水的反應;亞鐵離子具有還原性,次氯酸根離子具有氧化性,在溶液中發生氧化還原反應;
(3)取一定體積KAl(SO4)2溶液于試管中,逐滴加入一定濃度的Ba(OH)2溶液,直至產生沉淀的質量最大,此時生成硫酸鋇和偏鋁酸鉀.
解答 解:(1)NaClO為離子化合物,電子式為 ,用氯化鈉為原料,在堿性溶液中,通過電解的方法可制得NaClO,陽極生成NaClO,陰極生成氫氣,反應的離子方程式為:Cl-+H2O$\frac{\underline{\;通電\;}}{\;}$ClO-+H2↑;ClO-有氧化性,能夠氧化SO32-,反應的離子方程式為ClO-+SO32-=Cl-+SO42-,
,用氯化鈉為原料,在堿性溶液中,通過電解的方法可制得NaClO,陽極生成NaClO,陰極生成氫氣,反應的離子方程式為:Cl-+H2O$\frac{\underline{\;通電\;}}{\;}$ClO-+H2↑;ClO-有氧化性,能夠氧化SO32-,反應的離子方程式為ClO-+SO32-=Cl-+SO42-,
故答案為: ;Cl-+H2O$\frac{\underline{\;通電\;}}{\;}$ClO-+H2↑;ClO-+SO32-=Cl-+SO42-;
;Cl-+H2O$\frac{\underline{\;通電\;}}{\;}$ClO-+H2↑;ClO-+SO32-=Cl-+SO42-;
(2)次氯酸根離子水解顯堿性,鋁離子水解顯酸性,混合后水解相互促進,產生大量的白色膠狀沉淀和次氯酸,反應的離子方程式為:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;將燒瓶中的混合液在陽光照射下,不久燒瓶中有黃綠色氣體產生為氯氣,充分反應后集氣瓶中收集到一種無色無味的氣體為氧氣.依據氧化還原反應電子守恒寫出化學方程式配平得到:4HClO$\frac{\underline{\;光照\;}}{\;}$2H2O+2Cl2↑+O2↑;若將分液漏斗中的KAl(SO4)2溶液換成硫酸亞鐵銨(一種復鹽:(NH4)2SO4•FeSO4)溶液,其他不變.打開分液漏斗活塞向燒瓶中滴入足量的硫酸亞鐵銨溶液.觀察到燒瓶中有紅褐色沉淀產生,但是沒有觀察到黃綠色氣體產生,亞鐵離子具有還原性,次氯酸根離子教育氧化性在溶液中發生氧化還原反應,反應的離子方程式為:3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-,
故答案為:3ClO-+Al3++3H2O=3HClO+Al(OH)3↓;4HClO$\frac{\underline{\;光照\;}}{\;}$2H2O+2Cl2↑+O2↑;3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-;
(3)假設SO42-的物質的量為2mol,則明礬溶液中含有2mol SO42-,1molAl3+,向明礬溶液中逐滴加入Ba(OH)2溶液至鋁離子完全沉淀時生成1mol氫氧化鋁,1.5mol硫酸鋇,質量為1mol×78g/mol+1.5mol×233g/mol=427.5g,
SO42-剛好沉淀完全時,需要2molBa(OH)2,即加入的Ba2+為2mol,OH-為4mol,生成2molBaSO4,1molAl3+與4molOH-反應生成1molAlO2-,沉淀的質量為2mol×233g/mol=466g,則全完生成硫酸鋇時沉淀質量最大,反應的離子方程式為Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,
故答案為:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.
點評 本題考查較為綜合,涉及電解、離子方程式的書寫以及計算等問題,為高頻考點,側重于學生的分析、計算能力的考查,注意把握與量有關的離子方程式的書寫,難度中等.


 作業輔導系列答案
作業輔導系列答案科目:高中化學 來源: 題型:選擇題
| A. | 斷開1 mol H-H的同時斷開2 mol N-H | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2與H2的物質的量之和是NH3的物質的量2倍 | |
| D. | 單位時間里每增加1molN2,同時增加3molH2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶事先未烘干 | B. | 定容時觀察液面仰視 | ||
| C. | 定容時觀察液面俯視 | D. | 定容,搖勻后有少量液體流出 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 定容時俯視觀察液面 | |
| B. | 容量瓶中原有少量蒸餾水 | |
| C. | 溶解所用的燒杯、玻璃棒未洗滌 | |
| D. | 轉移溶液時不慎將少量液體灑落在外 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下2.24 L己烷中,分子數為0.1NA | |
| B. | 22.4 L Cl2含有Cl-Cl鍵數為NA | |
| C. | 常溫常壓下16 g O2和O3混合氣體中,氧原子數為NA | |
| D. | 7.8 g Na2O2與足量水反應,轉移電子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
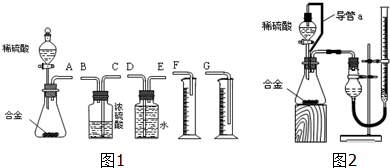
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是某學校實驗室從化學試劑商店買回的濃鹽酸試劑標簽上的部分內容.現用該濃鹽酸配制250mL 2mol•L-1的稀鹽 酸.可供選用的儀器有:①膠頭滴管;②燒瓶;③燒杯;④藥匙; ⑤量筒;⑥托盤天平;⑦玻璃棒.請回答下列問題:
如圖是某學校實驗室從化學試劑商店買回的濃鹽酸試劑標簽上的部分內容.現用該濃鹽酸配制250mL 2mol•L-1的稀鹽 酸.可供選用的儀器有:①膠頭滴管;②燒瓶;③燒杯;④藥匙; ⑤量筒;⑥托盤天平;⑦玻璃棒.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 CuCl和CuCl2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等.已知:
CuCl和CuCl2都是重要的化工原料,常用作催化劑、顏料、防腐劑和消毒劑等.已知:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com