
分析 硝酸越稀,還原產物中氮元素的價態越低.金屬X跟過量稀硝酸反應,在反應過程中未見有氣體生成,則說明硝酸被還原為NH3,又接著被HNO3吸收生成了NH4NO3,在所得溶液中加入熱堿溶液可放出一種氣體即為NH3,根據氨氣的體積求出其物質的量,設每失去1mol電子所需要的X的質量為Mg,即金屬X的平均摩爾電子質量為Mg/mol,然后根據得失電子數守恒來計算.
解答 解:硝酸越稀,還原產物中氮元素的價態越低.金屬X跟過量稀硝酸反應,在反應過程中未見有氣體生成,則說明硝酸被還原為NH3,又接著NH3被HNO3吸收生成了NH4NO3,故表現為無氣體生成.在所得溶液中加入熱堿溶液可放出一種氣體即為NH3,體積為280mL,則生成的氨氣的物質的量n=$\frac{0.28L}{22.4L/mol}$=0.0125mol.
設每失去1mol電子所需要的X的質量為Mg,即金屬X的平均摩爾電子質量為Mg/mol,故3.25g金屬X失去的電子的物質的量n=$\frac{3.25g}{Mg/mol}$=$\frac{3.25}{M}$mol ①
而由硝酸生成0.0125mol氨氣時的電子的物質的量n=0.0125mol×8=0.1mol ②
根據在氧化還原反應中得失電子數守恒可知:$\frac{3.25}{M}$=0.1
解得M=32.5g/mol.
即此金屬X每失去1mol電子所需的質量為32.5g,此金屬為鋅.
故答案為:鋅.
點評 本題考查了在氧化還原反應中的得失電子數守恒的有關計算,應注意的是平衡摩爾電子質量的應用,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 150mL1mol•L-1 NaCl溶液 | B. | 75 mL 0.5mol•L-1 CaCl2溶液 | ||
| C. | 150mL2mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 控制適合的條件,將反應Fe3++Ag?Fe2++Ag+設計成如右圖所示的原電池,(鹽橋裝有瓊脂-硝酸鉀溶液;靈敏電流計的0刻度居中,左右均有刻度)已知,接通后,觀察到電流計指針向右偏轉.下列判斷正確的是( )
控制適合的條件,將反應Fe3++Ag?Fe2++Ag+設計成如右圖所示的原電池,(鹽橋裝有瓊脂-硝酸鉀溶液;靈敏電流計的0刻度居中,左右均有刻度)已知,接通后,觀察到電流計指針向右偏轉.下列判斷正確的是( )| A. | 在外電路中,電子從石墨電極流向銀電極 | |
| B. | 鹽橋中的K+移向乙燒杯 | |
| C. | 一段時間后,電流計指針反向偏轉,越過0刻度,向左邊偏轉 | |
| D. | 電流計指針居中后,往甲燒杯中加入一定量的鐵粉,電流計指針將向左偏轉 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.5p mol | B. | (3m+n/2)mol | C. | (3m+n)mol | D. | (3m+n/2-3 p)mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
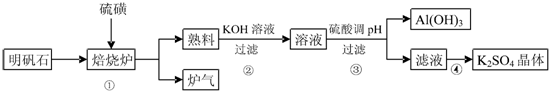
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com