
【題目】一種含鋁、鋰、鈷的新型電子材料,生產中產生的廢料數量可觀,廢料中的鋁以金屬鋁箔的形式存在:鈷以Co2O3·CoO的形式存在,吸附在鋁箔的單面或雙面;鋰混雜于其中。從廢料中回收氧化鈷(CoO)工藝流程如下:
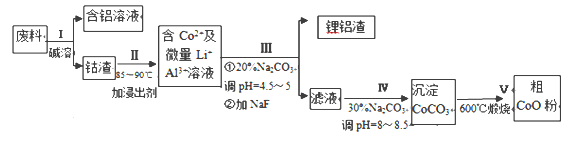
(1)過程Ⅰ中采用NaOH溶液溶出廢料中的Al,反應的離子方程式為_________________。
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出鈷。則浸出鈷的化學反應方程式為 (產物中只有一種酸根)_________。在實驗室模擬工業生產時,也可用鹽酸浸出鈷,但實際工業生產中不用鹽酸,請從氧化還原和環境保護的角度分析不用鹽酸浸出鈷的主要原因____。
(3)過程Ⅲ得到鋰鋁渣的主要成分是LiF和Al(OH)3,碳酸鈉溶液在產生Al(OH)3時起重要作用,請寫出該反應的離子方程式_____ 。
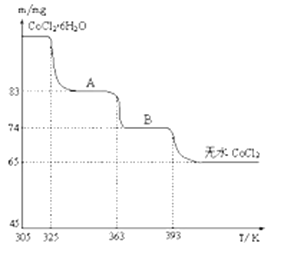
(4)如圖是CoCl2.6H2O晶體受熱分解時,剩余固體的質量隨溫度變化的曲線,B物質的化學式是______________ 。
【答案】2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 4Co3O4 + Na2S2O3+ 11H2SO4= 12CoSO4+ Na2SO4+11H2O Co2O3·CoO可氧化鹽酸產生Cl2,污染環境 2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑ CoCl2. H2O
【解析】
操作Ⅰ利用了鋁能溶解在氫氧化鈉溶液的性質,將鋁從廢料中分離出來,過濾后得到含Co2O3CoO的鈷渣,再用酸溶解過濾后得到含Co3+及Al3+、Li+的濾液,通過調整溶液的pH得到Al(OH)3和LiF沉淀,再過濾得到含Co3+的濾液,再滴加Na2CO3溶液得到CoCO3沉淀,經過濾、洗滌沉淀,最后將CoCO3進行加熱分解可得CoO粉末。
(1)鋁和氫氧化鈉溶液反應生成四羥基合鋁酸鈉和氫氣,離子反應方程式為:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(2)Co3O4和Na2S2O3在酸性條件下發生氧化還原反應生成CoSO4、Na2SO4和H2O,反應方程式為:4Co3O4 + Na2S2O3+ 11H2SO4= 12CoSO4+ Na2SO4+11H2O,鹽酸具有還原性,能被Co2O3CoO氧化生成有毒的氯氣而污染環境,不能用鹽酸;
(3)鋁離子能與碳酸根離子發生雙水解生成氫氧化鋁和二氧化碳,水解的離子方程式為:2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑;
(4)根據圖象可知,加熱時Co的物質的量不變,由A到B減少9mg,由B到無水CoCl2減少9g,65mg的物質的量為0.5![]() 10-3mol,9mg水的物質的量為0.5
10-3mol,9mg水的物質的量為0.5![]() 10-3mol,則B的化學式為CoCl2. H2O。
10-3mol,則B的化學式為CoCl2. H2O。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
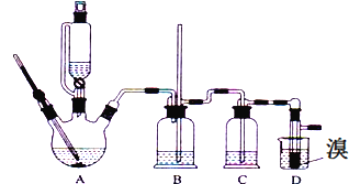
【題目】實驗室用少量的溴和足量的乙醇、濃硫酸制備1,2﹣二溴乙烷的裝置如下圖所示,其中可能存在的主要副反應有:乙醇在濃硫酸的存在下在l40℃脫水生成乙醚。有關數據列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | -l30 | 9 | -1l6 |
回答下列問題:
(1)用少量的溴和足量的乙醇、濃硫酸制備1,2﹣二溴乙烷的需分兩步進行,第二步反應的化學方程式為_______________
(2)在此實驗中,要盡可能迅速地把反應溫度提高到170℃左右,其最主要目的是_______(填正確選項前的字母)。
a.引發反應 b.加快反應速度 c.防止乙醇揮發 d.減少副產物乙醚生成
(3)在裝置C中應加入_______,其目的是吸收反應中可能生成的酸性氣體(填正確選項前的字母)。
a.水 b.濃硫酸 c.氫氧化鈉溶液 d.飽和碳酸氫鈉溶液
(4)將1,2﹣二溴乙烷粗產品置于分液漏斗中加水,振蕩后靜置,產物應在________層(填“上”、“下”)。
(5)若產物中有少量未反應的Br2,最好用__________洗滌除去(填選項前字母)。
a.水 b.氫氧化鈉溶液 c.碘化鈉溶液 d.乙醇
(6)若產物中有少量副產物乙醚.可用__________的方法除去。
(7)反應過程中應用冷水冷卻裝置D,其主要目的是乙烯與溴反應時放熱,冷卻可避免溴的大量揮發;但又不能過度冷卻(如用冰水),其原因是_____________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某氧化鐵樣品中含有少量的硫酸亞鐵。某同學要測定其中鐵元素的質量分數,設計了如下實驗方案。

(1)操作Ⅰ中配制溶液時,所用到的玻璃儀器除燒杯、量筒、玻璃棒、膠頭滴管以外,還必須有__________(填儀器名稱)。
(2)反應①中加入足量H2O2溶液,反應的離子方程式:_______________________________。
(3)檢驗沉淀中![]() 是否洗滌干凈的操作是_______________________________________。
是否洗滌干凈的操作是_______________________________________。
(4)將沉淀加熱,冷卻至室溫,用天平稱量坩堝與加熱后固體的總質量為b1g,再次加熱并冷卻至室溫稱其質量為b2g,若b1-b2=0.3,還應進行的操作是_____________________。
(5)坩堝的質量為42.6 g,最終坩堝與加熱后的固體的總質量為45.8 g,則樣品中鐵元素的質量分數為________________。
(6)有同學認為上述方案的實驗步驟太繁瑣,他認為,只要將樣品溶于水充分攪拌,加熱、蒸干、灼燒稱量即可測得樣品中鐵元素的質量分數,你認為他的這個方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴化鈣具有易溶于水、易吸潮等性質。溴化鈣可用作阻燃劑、制冷劑,實驗室用工業大理石(含有少量Al3+、Fe3+等雜質)制備溴化鈣的主要流程如下:
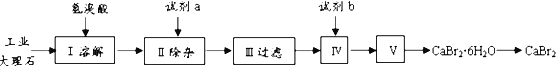
回答下列問題:
(1)已知步驟III的濾液中不含NH4+。步驟II加入的試劑a是___________,控制溶液的pH約為8.0的目的是___________、___________。
(2)試劑b是___________,步驟IV的目的是_______。
(3)步驟V所含的操作依次是________________、過濾。
(4)制得的溴化鈣可以通過如下步驟測定其純度:
稱取4.00g無水溴化鈣樣品;溶解;滴入足量Na2CO3溶液,充分反應;過濾;烘干;冷卻。若得到1.88g碳酸鈣,則溴化鈣的質量分數為_________。 若實驗操作規范而測定結果偏低,其原因是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D是中學常見的混合物分離或提純的基本裝置。
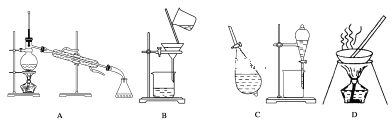
請根據混合物分離或提純的原理,回答在下列實驗中需要使用哪種裝置。將A、B、C、D填入適當的空格中。
(1)除去Fe(OH)3膠體中懸浮的Fe(OH)3沉淀___;
(2)從碘水中提取碘___;
(3)用自來水制取蒸餾水___;
(4)除去粗鹽中的泥沙___;
(5)與海水曬鹽原理相符的是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學采用硫鐵礦焙燒取硫后的燒渣(主要成分為Fe2O3、SiO2、Al2O3,不考慮其他雜質)制取七水合硫酸亞鐵(FeSO4·7H2O),設計了如下流程:

下列說法不正確的是( )
A. 溶解燒渣選用足量硫酸,試劑X選用鐵粉
B. 固體1中一定含有SiO2,控制pH是為了使Al3+轉化為Al(OH)3,進入固體2
C. 從溶液2得到FeSO4·7H2O產品的過程中,須控制條件防止其氧化和分解
D. 若改變方案,在溶液1中直接加NaOH至過量,得到的沉淀用硫酸溶解,其溶液經結晶分離也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.在450℃并有催化劑存在下,在容積恒定的密閉容器內進行下列反應:2SO2 (g)+O2(g)![]() 2SO3(g) △H=-190kJmol-1
2SO3(g) △H=-190kJmol-1
(1)該反應500℃時的平衡常數____450℃時的平衡常數(填“>”、“<”或“=”)。
(2)450℃時,在2L密閉容器中,將二氧化硫和氧氣混合,反應過程中SO2、O2、SO3物質的量變化如圖,反應處于平衡狀態的時間是____。
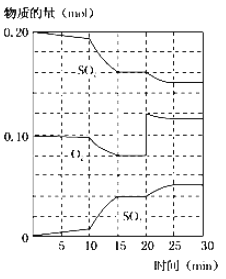
(3)據上圖判斷,反應進行至20min時,曲線發生變化的原因是___(用文字表達),10min到15min的曲線變化的原因可能是___(填字母)。
a.加了催化劑 b.縮小容器體積 c.降低溫度 d.增加SO3物質的量
(4)欲提高SO2的轉化率,下列措施可行的是___。(填字母)
a.向裝置中充入N2 b.向裝置中再充入O2
c.改變反應的催化劑 d.升高溫度
II.已知HCl+O2![]() Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的熱量,且部分化學鍵斷裂示意圖如下:
Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的熱量,且部分化學鍵斷裂示意圖如下:
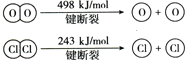
①寫出該反應的熱化學方程式是_____。
②斷開1 mol H—O鍵與斷開 1 mol H—Cl鍵所需能量相差約為___kJ,H2O中H—O鍵比HCl中H—Cl鍵_____(填“強”或“弱”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖表示溶液中c(H+)和c(OH-)的關系,下列判斷錯誤的是
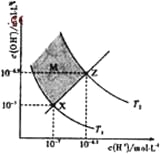
A. 兩條曲線間任意點均有c(H+)×c(OH-)=Kw
B. M區域內任意點均有c(H+)<c(OH-)
C. 圖中T1<T2
D. XZ線上任意點均有pH=7
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com