
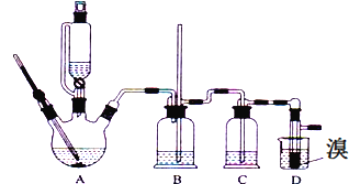
【題目】實驗室用少量的溴和足量的乙醇、濃硫酸制備1,2﹣二溴乙烷的裝置如下圖所示,其中可能存在的主要副反應有:乙醇在濃硫酸的存在下在l40℃脫水生成乙醚。有關數據列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
狀態 | 無色液體 | 無色液體 | 無色液體 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸點/℃ | 78.5 | 132 | 34.6 |
熔點/℃ | -l30 | 9 | -1l6 |
回答下列問題:
(1)用少量的溴和足量的乙醇、濃硫酸制備1,2﹣二溴乙烷的需分兩步進行,第二步反應的化學方程式為_______________
(2)在此實驗中,要盡可能迅速地把反應溫度提高到170℃左右,其最主要目的是_______(填正確選項前的字母)。
a.引發反應 b.加快反應速度 c.防止乙醇揮發 d.減少副產物乙醚生成
(3)在裝置C中應加入_______,其目的是吸收反應中可能生成的酸性氣體(填正確選項前的字母)。
a.水 b.濃硫酸 c.氫氧化鈉溶液 d.飽和碳酸氫鈉溶液
(4)將1,2﹣二溴乙烷粗產品置于分液漏斗中加水,振蕩后靜置,產物應在________層(填“上”、“下”)。
(5)若產物中有少量未反應的Br2,最好用__________洗滌除去(填選項前字母)。
a.水 b.氫氧化鈉溶液 c.碘化鈉溶液 d.乙醇
(6)若產物中有少量副產物乙醚.可用__________的方法除去。
(7)反應過程中應用冷水冷卻裝置D,其主要目的是乙烯與溴反應時放熱,冷卻可避免溴的大量揮發;但又不能過度冷卻(如用冰水),其原因是_____________________
【答案】CH2=CH2+Br2→CH2BrCH2Br d c 下 b 蒸餾 過度冷卻會使其凝固而使氣路(或導管)堵塞
【解析】
(1)用少量的溴和足量的乙醇、濃硫酸制備1,2-二溴乙烷的需分兩步進行,反應原理如下:第一步反應為CH3CH2OH![]() CH2=CH2+H2O,第二步反應為CH2=CH2+Br2→BrCH2CH2Br;
CH2=CH2+H2O,第二步反應為CH2=CH2+Br2→BrCH2CH2Br;
(2)乙醇在濃硫酸140℃的條件下,發生分子內脫水生成乙醚,可迅速地把反應溫度提高到170℃左右,其最主要目的是:減少副產物乙醚生成,選擇d;
故答案為:d;
(3)濃硫酸具有強氧化性,將乙醇氧化成二氧化碳,自身被還原成二氧化硫,二氧化碳、二氧化硫能和氫氧化鈉溶液反應而被吸收,故選c,
故答案為:c;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,有機層在下層,
故答案為:下;
(5)a.溴可溶于1,2-二溴乙烷,用水無法除去溴,選項a錯誤;
b.常溫下Br2和氫氧化鈉發生反應:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,選項b正確;
c.NaI與溴反應生成碘,碘可溶于1,2-二溴乙烷,不能分離,選項c錯誤;
d.酒精與1,2-二溴乙烷互溶,不能除去混有的溴,選項d錯誤,
故答案為:b;
(6)1,2-二溴乙烷與乙醚的沸點不同,兩者均為有機物,互溶,用蒸餾的方法將它們分離,
故答案為:蒸餾;
(7)溴在常溫下易揮發,乙烯與溴反應時放熱,溴更易揮發,冷卻可避免溴的大量揮發,但1,2-二溴乙烷的凝固點為9℃,溫度較低,不能過度冷卻,過度冷卻會使其凝固而使氣路堵塞,B中長導管內液面上升,
故答案為:冷卻可避免溴的大量揮發;1,2-二溴乙烷的凝固點較低(9℃),過度冷卻會使其凝固而使氣路堵塞。


科目:高中化學 來源: 題型:
【題目】有機物G為高分子材料,其一種合成路線如圖:
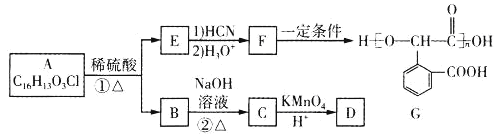
已知:①B的分子式為C8H9OCl
②R-CHO![]() R-CH(OH)COOH
R-CH(OH)COOH
回答下列問題:
(1)D的兩個含氧官能團相鄰,1molD與足量碳酸氫鈉溶液反應可生成2molCO2,D的名稱是_____,其核磁共振氫譜有____組吸收峰。
(2)②的反應類型是____。
(3)E的含氧官能團的名稱為_____。
(4)①的化學方程式為_____。
(5)X是E的同分異構體,X含有苯環且苯環上的一氯代物有2種,能發生銀鏡反應,遇氯化鐵溶液顯紫色。寫出3種符合要求的X的結構簡式______。
(6)參照上述合成路線,設計以![]() 為原料合成G的路線(無機試劑任選)_____。
為原料合成G的路線(無機試劑任選)_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A.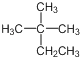 的系統命名為2甲基2乙基丙烷
的系統命名為2甲基2乙基丙烷
B.用酸性KMnO4溶液可以確定CH2=CHCHO中含有C=C雙鍵
C.在酸性條件下,CH3CO18OC2H5的水解產物是CH3COOH和C2H518OH
D.乙烯和聚氯乙烯都能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車尾氣中的主要污染物為NOx、CO等有害物質。目前,已研究出了多種消除汽車尾氣污染的方法。
I.催化劑存在時用H2將NO還原為N2。
已知: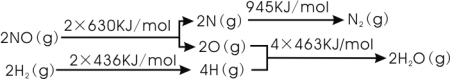
則H2還原NO生成氮氣和水蒸氣的熱化學方程式是:______________________________。
II.用活性炭還原處理氮氧化物,有關反應為C(s)+2NO(g)![]() N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密閉器中加入足量的C與NO反應,所得實驗數據如表
N2(g)+CO2(g)△H=QkJ/mol,在2L恒容密閉器中加入足量的C與NO反應,所得實驗數據如表
實驗編號 | 溫度/℃ | 起始時NO的物質的量/mol | 平衡時N2的物質的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
(1)寫出該反應的平衡常數表達式________________________________________。
(2)結合表中數據,判斷該反應的Q___0(填“>”或“<”),理由是________________________。.
(3)用電子式表示產物CO2的形成過程_________________________________________。
(4)判斷該反應達到平衡的依據是____________
a.若容器內氣體密度恒定,反應達到平衡狀態
b.若容器內各氣體濃度恒定,反應達到平衡狀態
c.若容器內壓強恒定,反應達到平衡狀態
d.若2υ正(NO)=υ逆(N2),反應達到平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】聚合物F的合成路線圖如圖:

已知:HCHO+RCH2CHO![]()
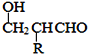
![]()
![]()
請據此回答:
(1)A中含氧官能團名稱是________________,C的系統命名為_____________________ 。
(2)檢驗B中所含官能團所用的試劑有______________、_____________;E→F的反應類型是______________,B+D![]() E的反應類型是______________________。
E的反應類型是______________________。
(3)寫出A→B的化學方程式__________________________________________________。
(4)寫出C→D的化學方程式__________________________________________________。
(5)參照上述合成路線,設計一條由甲醛、乙醛和甲醇為主要原料制備![]() 的合成路線_______________________________________________________________
的合成路線_______________________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】磷是地殼中含量較為豐富的非金屬元素,它的單質和化合物在工農業生產中應用廣泛。白磷可通過反應 2Ca3(PO4)2+10C→6CaO+P4+10CO 獲得。完成下列填空:
(1)磷原子的最外層電子排布式是__________,氧原子核外有______種不同運動狀態的電子。C、O兩種元素非金屬性較強的是_______________。
(2)白磷在空氣中露置時間長了會因溫度達到____而自燃,使白磷升溫的熱量主要來自_________。某溫度時,在2.0L恒容密閉容器中充入0.5mol PCl5,發生反應PCl5(g)![]() PCl3(g)+Cl2(g)-Q,經過一段時間后達到平衡。
PCl3(g)+Cl2(g)-Q,經過一段時間后達到平衡。
(3)該反應的平衡常數表達式 K=_____________;
(4)其他條件不變,起始時向上述容器中充入1.0 mol PCl5,達到平衡時,PCl5的轉化率____(選填“增大”、 “減小”“不變”),平衡常數 K____(選填“增大”、 “減小”“不變”)。
(5)在不同時間(t)測得反應過程中 PCl5 的部分數據如下:
t(s) | 0 | 50 | 100 | 250 | 350 |
n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
則 100s 時, PCl3的物質的量濃度是__________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知和碳元素同主族的X元素位于元素周期表中的第一個長周期,短周期元素Y原子的最外層電子數比內層電子總數少3,它們形成化合物的分子式是XY4。試回答:
(1)X元素的原子基態時電子排布式為:___________________________________,Y元素原子最外層電子的電子排布圖為:____________。
(2)若X、Y兩元素電負性分別為2.1和2.85,試判斷XY4中X與Y之間的化學鍵為________(填“共價鍵”或“離子鍵”)。
(3)該化合物的空間結構為______________形,中心原子的軌道雜化類型為__________,分子為______________(填“極性分子”或“非極性分子”)。
(4)該化合物在常溫下為液體,該液體微粒間的作用力是____________。
(5)該化合物的沸點與SiCl4比較:________(填化學式)的高,原因是_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苦杏仁酸在醫藥工業可用于合成頭孢羥唑、羥芐唑、匹莫林等的中間體,下列路線是合成苦杏仁酸及其衍生物的一種方法:

(1)試寫出B的結構簡式_____,C中官能團的名稱為_____。
(2)反應①的反應類型為_____,D的核磁共振氫譜共有_____組峰。
(3)1molE最多可以與_____molNaOH反應。反應③的化學方程式為_____。
(4)兩個C分子可以反應生成具有三個六元環的化合物F,則F的結構簡式為_____。
(5)寫出滿足下列條件的C的同分異構體的結構簡式_____。
A.既能發生銀鏡反應,又能發生水解反應
B.遇FeCl3能顯紫色
C.苯環上具有兩個位于對位的取代基
(6)已知:RCH2COOH![]() RCHClCOOH,請以冰醋酸為原料(無機試劑任選)設計制備聚乙醇酸(
RCHClCOOH,請以冰醋酸為原料(無機試劑任選)設計制備聚乙醇酸(![]() )的合成路線_____。
)的合成路線_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種含鋁、鋰、鈷的新型電子材料,生產中產生的廢料數量可觀,廢料中的鋁以金屬鋁箔的形式存在:鈷以Co2O3·CoO的形式存在,吸附在鋁箔的單面或雙面;鋰混雜于其中。從廢料中回收氧化鈷(CoO)工藝流程如下:
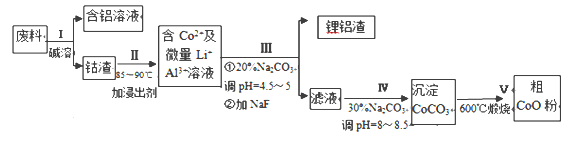
(1)過程Ⅰ中采用NaOH溶液溶出廢料中的Al,反應的離子方程式為_________________。
(2)過程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出鈷。則浸出鈷的化學反應方程式為 (產物中只有一種酸根)_________。在實驗室模擬工業生產時,也可用鹽酸浸出鈷,但實際工業生產中不用鹽酸,請從氧化還原和環境保護的角度分析不用鹽酸浸出鈷的主要原因____。
(3)過程Ⅲ得到鋰鋁渣的主要成分是LiF和Al(OH)3,碳酸鈉溶液在產生Al(OH)3時起重要作用,請寫出該反應的離子方程式_____ 。
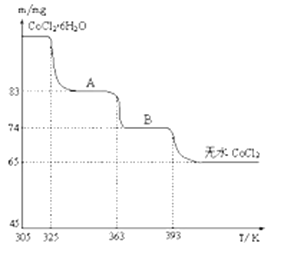
(4)如圖是CoCl2.6H2O晶體受熱分解時,剩余固體的質量隨溫度變化的曲線,B物質的化學式是______________ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com