
| A. | 0.5mol Mg與足量鹽酸反應生成氫氣的體積為11.2升 | |
| B. | 標準狀況下,11.2L SO2所含的原子數為1.5NA | |
| C. | 8gCH4所含的氫原子數為0.5NA | |
| D. | 46g NO2和N2O4的混合物所含的分子數為1NA |
分析 A.沒有告訴在標準狀況下,不能使用標況下的氣體摩爾體積計算;
B.根據n=$\frac{V}{{V}_{m}}$計算出二氧化硫的物質的量,然后計算出含有原子的物質的量及數目;
C.根據n$\frac{m}{M}$計算出甲烷的物質的量,然后可計算出含有原子的物質的量及數目;
D.NO2和N2O4的摩爾質量不同,無法計算混合物中含有分子數.
解答 解:A.不是標況下,不能使用標準狀況下的氣體摩爾體積計算生成氫氣的體積,故A錯誤;
B.標準狀況下,11.2L SO2的物質的量為:$\frac{11.2L}{22.4L/mol}$=0.5mol,0.5mol二氧化硫含有1.5mol原子,含有的原子數為1.5NA,故B正確;
C.8gCH4的物質的量為:$\frac{8g}{16g/mol}$=0.5mol,0.5mol甲烷中含有氫原子的物質的量為:0.5mol×4=2mol,含有氫原子數為2NA,故C錯誤;
D.NO2和N2O4的摩爾質量分別為46g/mol、92g/mol,無法計算46g混合物的物質的量及含有分子數,故D錯誤;
故選B.
點評 本題考查阿伏加德羅常數的綜合應用,題目難度中等,注意明確標況下氣體摩爾體積的使用條件,掌握好以物質的量為中心的各化學量與阿伏加德羅常數的關系,試題有利于培養學生的邏輯推理能力,提高學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:解答題
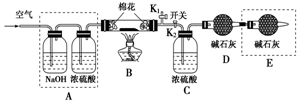 為探究所得的水合堿式碳酸鎂[mMgCO3•nMg(OH)2•x
為探究所得的水合堿式碳酸鎂[mMgCO3•nMg(OH)2•x查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (1)(2)(3)(5) | B. | (1)(3)(5) | C. | (2)(3)(6) | D. | (1)(3)(4)(5) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在0.1mol/LNaHCO3溶液中:Al3+、NH4+、SO42-、NO3- | |
| B. | 常溫下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液中:K+,Cl-,Fe2+,NO3- | |
| C. | 使甲基橙變紅的溶液中:NH4+,Cl-,SO2-,Mg2+ | |
| D. | 25℃時,水電離出的c(H+)=1×10-13mol/L:K+,Ba2+,NO3-,S2- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯的三氯代物一共有 5 種 | |
| B. | 乙烯和乙酸均能發生加成反應 | |
| C. | 乙烷通入氯水中能發生取代反應 | |
| D. | 淀粉和纖維素都屬于天然高分子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用小蘇打治療胃酸過多:HCO3-+H+═CO2↑+H2O | |
| B. | 純堿溶液與石灰水反應:Ca2++CO32-=CaCO3↓ | |
| C. | 銅粉與硝酸銀溶液反應:Ag++Cu═Ag+Cu2+ | |
| D. | 鹽酸滴在石灰石上:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用磨口玻璃瓶保存NaOH溶液 | |
| B. | 使用容量瓶配制100g 36%的NaCl溶液 | |
| C. | 稀硝酸可除去試管內壁的銀鏡 | |
| D. | 加熱可除去NaHCO3固體中混有的Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 200mL0.5mol/LNaCl溶液 | B. | 100mL0.8mol/LNaBr溶液 | ||
| C. | 800mL0.3mol/LNa2CO3溶液 | D. | 1000mL0.6mol/LNaNO3溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com