
| A. | 加入10mL 的水進行稀釋 | B. | 加水稀釋成100mL | ||
| C. | 加入45mL 0.01mol/L的NaOH溶液 | D. | 加入10mL 0.01mol/L的鹽酸溶液 |
分析 常溫下pH=1的某強酸溶液中c(H+)=0.1mol/L,使溶液的pH變成2,即c(H+)=0.01mol/L,可加水稀釋或加入一定量的堿進行中和,使溶液中c(H+)=0.01mol/L即可,據此進行解答.
解答 解:常溫下pH=1的某強酸溶液中c(H+)=0.1mol/L,使溶液的pH變成2,此時溶液中c(H+)=0.01mol/L,
A.加入10mL的水進行稀釋,混合后溶液中c(H+)=$\frac{0.01mol}{0.02L}$=0.05mol/L≠0.01mol/L,故A錯誤;
B.加水稀釋成100mL,稀釋后的溶液中c(H+)=0.01mol/L,故B正確;
C.pH=1的某強酸溶液10mL,n(H+)=0.01L×0.1mol/L=0.001mol,加入45mL 0.01mol/L的NaOH溶液,n(OH-)=0.045L×0.01mol/L=0.00045mol,混合后c(H+)=$\frac{0.01mol-0.00045mol}{0.055L}$≠0.01mol/L,故C錯誤;
D.加入10mL0.01mol/L的鹽酸,混合后,c(H+)=$\frac{0.01mol+0.01L×0.01mol/L}{0.02L}$≠0.01mol/L,故D錯誤;
故選B.
點評 本題考查酸堿混合的計算和判斷,題目難度中等,明確溶液酸堿性與溶液pH的關系為解答關鍵,注意掌握pH的概念及表達式,試題培養了學生的化學計算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1mol酸與1mol堿完全反應放出的熱量就是中和熱 | |
| B. | 如果反應在加熱時才能發生,則該反應是吸熱反應 | |
| C. | 反應物總能量大于生成物總能量,則反應的△H<0 | |
| D. | 強酸強堿中和熱的離子方程式可表示為:H+(aq)+OH-(aq)═H2O(l)△H=57.3 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用催化設施,可以將汽車尾氣中CO和NO轉化為無害氣體 | |
| B. | PM2.5(2.5微米以下的細顆粒物)主要來自化石燃料的燃燒 | |
| C. | 半導體行業中有一句話:“從沙灘到用戶”,計算機芯片的材料是二氧化硅 | |
| D. | 防止酸雨發生的重要措施之一是使用清潔能源 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
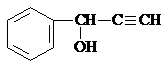 、
、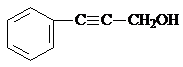 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | .質子數等于電子數的某微粒,可能是一種分子或一種離子 | |
| B. | 只由一種分子組成的物質一定為純凈物 | |
| C. | 3517Cl與3717Cl互為同位素 | |
| D. | 1molNa2O2晶體與1molNa2O晶體中所含陰陽離子總數相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
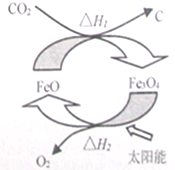
| A. | 由二氧化碳制取碳和氧氣的反應為放熱反應 | |
| B. | 該循環反應中,FeO的質量減小 | |
| C. | 根據蓋斯定律可知,△H1+△H2=0 | |
| D. | 該反應是將太陽能轉化為化學能 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe分別與氯氣和稀鹽酸反應所得氯化物不同 | |
| B. | 銅的金屬活動性比鋁弱,可用銅罐代替鋁罐貯運濃硝酸 | |
| C. | SO2、NO2都能與水反應,其反應原理相同 | |
| D. | N2的化學性質通常非常穩定,但在放電條件下可以與O2反應生成NO2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com