
物質(t-BuNO)2在正庚烷或CCl4中均可以發生反應:(t-BuNO)2 2(t-BuNO)。在20℃時,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min時反應達平衡,此時(t-BuNO)2的平衡轉化率為75%(假設反應過程中溶液體積始終為2 L)。下列說法正確的是
2(t-BuNO)。在20℃時,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min時反應達平衡,此時(t-BuNO)2的平衡轉化率為75%(假設反應過程中溶液體積始終為2 L)。下列說法正確的是
| A.反應在前10 min內的平均速率為ν(t-BuNO)=0.0375mol·L-1·min-1 |
| B.保持其他條件不變,若此時再向正庚烷反應體系中加入正庚烷,平衡向生成(t-BuNO)2的方向移動 |
| C.保持其他條件不變,升高溫度,(t-BuNO)2的平衡轉化率大于75%,則其能量關系可用右圖表示 |
| D.保持其他條件不變,若該反應在CCl4中進行,其平衡常數為1.9,則(t-BuNO)2的平衡轉化率大于75% |
 三新快車金牌周周練系列答案
三新快車金牌周周練系列答案科目:高中化學 來源: 題型:單選題
一定溫度下,在一個10 L密閉容器中發生某可逆反應,其平衡常數表達式為K=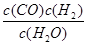 。請回答下列問題。
。請回答下列問題。
(1)該反應的化學方程式為______________________;
若溫度升高,K增大,則該反應是________反應(填“吸熱”或“放熱”)。
(2)能判斷該反應一定達到平衡狀態的是________(填字母序號)。
| A.v正(H2O)=v逆(H2) |
| B.容器中氣體的平均相對分子質量不隨時間改變 |
| C.消耗n mol H2的同時消耗n mol CO |
| D.容器中物質的總物質的量不隨時間改變 |

查看答案和解析>>
科目:高中化學 來源: 題型:單選題
鋁的以下反應得以進行的原因,可用勒沙特勒原理解釋的是
| A.與鹽酸反應產生氫氣 |
| B.在氯氣中燃燒 |
| C.放入硝酸汞溶液中表面形成鋁汞齊 |
| D.一定溫度下,用鋁與氧化鈣反應制得金屬鈣 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
20 ℃ 時,將0.1 mol/L Na2S2O3溶液10mL 和 0.1 mol/L H2SO4溶液10mL混合,2 min 后溶液出現明顯渾濁(發生的反應為Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)。已知溫度每升高10 ℃ ,該反應的化學反應速率增大到原來的2倍。那么50 ℃時,同樣的反應要明顯地出現渾濁,所需時間是
| A.48s | B.40s | C.20s | D.15s |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在密閉容器中,使2 mol N2和6 mol H2混合發生下列反應:N2(g)+3H2(g) 2NH3(g)(正反應為放熱反應)。下列說法錯誤的是
2NH3(g)(正反應為放熱反應)。下列說法錯誤的是
| A.升高平衡體系的溫度(保持體積不變),混合氣體的平均相對分子質量變大 |
| B.升高平衡體系的溫度(保持體積不變),混合氣體的密度不變 |
| C.當反應達到平衡時,N2和H2的濃度比是 1∶3 |
| D.當達到平衡時,充入氬氣,并保持壓強不變,平衡將逆向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
溫度為T時,向2.0L恒容密閉容器中充入1.0 molPCl5,反應PCl5(g) PCl3(g)+Cl2(g)經一段時間后達到平衡。反應過程中測定的部分數據見下表:
PCl3(g)+Cl2(g)經一段時間后達到平衡。反應過程中測定的部分數據見下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/ mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
汽車尾氣凈化中的一個反應如下:
在一容積為5L的恒容密閉容器中充人0.2 mol NO和0.5mol CO,5 min后該反應達到平衡,此時N2的物質的量為0.06mol。下列說法正確的是
| A.達到平衡后,若只升高溫度,化學平衡正向移動 |
| B.達到平衡后,再通人稀有氣體,逆反應速率增大 |
| C.使用催化劑,平衡常數不變 |
| D.0~5 min內,NO的反應速率為2.4×1 0-3 mol·L一1·min一1 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
將 4 mol A 氣體和 2 mol B 氣體在 2 L 的容器中混合并在一定條件下發生如下反應:2A(g)+B(g) 2C(g)若經 2 s(秒)后測得 C 的濃度為 0.6 mol·L-1 ,現有下列幾種說法:
2C(g)若經 2 s(秒)后測得 C 的濃度為 0.6 mol·L-1 ,現有下列幾種說法:
① 用物質 A 表示的反應的平均速率為 0.3 mol·L-1·S-1
② 用物質 B 表示的反應的平均速率為 0.6 mol·L-1·S-1
③ 2 s 時物質 A 的轉化率為70%
④ 2 s 時物質 B 的濃度為 0.7 mol·L-1,
其中正確的是
| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
汽車上的催化轉化器可將尾氣中的主要污染物轉化成無毒物質,反應為:
2NO(g)+2CO(g) N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
N2(g)+2CO2(g) DH=-a kJ/mol(a>0)
在某溫度時,用氣體傳感器測得不同時間的NO和CO濃度如下表:
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4 mol·L-1 | 10.0 | 4.05 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/10-3 mol·L-1 | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com