
鋁的以下反應得以進行的原因,可用勒沙特勒原理解釋的是
| A.與鹽酸反應產生氫氣 |
| B.在氯氣中燃燒 |
| C.放入硝酸汞溶液中表面形成鋁汞齊 |
| D.一定溫度下,用鋁與氧化鈣反應制得金屬鈣 |
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:單選題
在密閉容器中,使2 mol N2和6 mol H2混合發生下列反應:N2(g)+3H2(g)  2NH3(g)(正反應為放熱反應)。下列說法錯誤的是
2NH3(g)(正反應為放熱反應)。下列說法錯誤的是
| A.升高平衡體系的溫度(保持體積不變),混合氣體的平均相對分子質量變大 |
| B.升高平衡體系的溫度(保持體積不變),混合氣體的密度不變 |
| C.當反應達到平衡時,N2和H2的濃度比是 1∶3 |
| D.當達到平衡時,充入氬氣,并保持壓強不變,平衡將逆向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在一體積為10 L的容器中,通入一定量的CO和H2O,在850℃時發生如下反應:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0。
CO2(g)+H2(g) △H<0。
(1)CO和H2O濃度變化如圖,則在該溫度下,該反應的平衡常數K= 。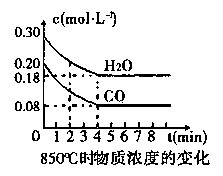
0~4 min的平均反應速率v(CO)= mol·L-1·min-1。若降低溫度,該反應的K值將 ,該反應的化學反應速率將 (填“增大”“減小”或“不變”)。
(2)在相同容器中發生上述反應,當溫度高于850℃時,容器內各物質的濃度變化如下表。
| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
難揮發性二硫化鉭(TaS2 )可采用如下裝置提純。將不純的TaS2 粉末裝入石英管一端,抽真空后引入適量碘并封管,置于加熱爐中。反應如下: TaS2(g)+ 2I2(g)TaI4(g) + S2(g),下列說法錯誤的是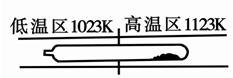
| A.在不同溫度區域,TaI4 的量不同 |
| B.在提純過程中,S2 的量不斷增多 |
| C.該反應的平衡常數不隨TaI4 和S2 的濃度增大而增大 |
| D.在提純過程中,I2 的作用是將TaS2 從高溫區轉移到低溫區 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定條件下,通過下列反應可以制備特種陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0
MgO(s)+CO2(g)+SO2(g) △H>0
該反應在恒容的密閉容器中達到平衡后,若僅改變圖中橫坐標x的值,重新達到平衡后;縱坐標y隨x變化趨勢合理的是
| 選項 | x | y |
| A | 溫度 | 容器內混合氣體的密度 |
| B | CO的物質的量 | CO2與CO的物質的量之比 |
| C | SO2的濃度 | 平衡常數K |
| D | MgSO4的質量(忽略體積) | CO的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
物質(t-BuNO)2在正庚烷或CCl4中均可以發生反應:(t-BuNO)2 2(t-BuNO)。在20℃時,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min時反應達平衡,此時(t-BuNO)2的平衡轉化率為75%(假設反應過程中溶液體積始終為2 L)。下列說法正確的是
2(t-BuNO)。在20℃時,向2 L正庚烷中加入(t-BuNO)2 1.0 mol,10 min時反應達平衡,此時(t-BuNO)2的平衡轉化率為75%(假設反應過程中溶液體積始終為2 L)。下列說法正確的是
| A.反應在前10 min內的平均速率為ν(t-BuNO)=0.0375mol·L-1·min-1 |
| B.保持其他條件不變,若此時再向正庚烷反應體系中加入正庚烷,平衡向生成(t-BuNO)2的方向移動 |
| C.保持其他條件不變,升高溫度,(t-BuNO)2的平衡轉化率大于75%,則其能量關系可用右圖表示 |
| D.保持其他條件不變,若該反應在CCl4中進行,其平衡常數為1.9,則(t-BuNO)2的平衡轉化率大于75% |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
一定條件下,C0與H2反應可生成乙醇:2CO+4H2? CH3CH20H+H20。下列關于該反應的說法錯誤的是
| A.增大CO的濃度能減小反應速率 |
| B.升高體系溫度能增大反應速率 |
| C.使用合適的催化劑可增大反應速率 |
| D.若反應在密閉容器中進行,H2和C0不能全部轉化為產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
在體積為2 L的恒容密閉容器中發生反應xA(g)+yB(g) zC(g),圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )。
zC(g),圖甲表示200 ℃時容器中A、B、C物質的量隨時間的變化,圖乙表示不同溫度下平衡時C的體積分數隨起始n(A)∶n(B)的變化關系。則下列結論正確的是( )。
A.200 ℃時,反應從開始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
B.由圖乙可知,反應xA(g)+yB(g)??zC(g)的ΔH<0,且a=2
C.若在圖甲所示的平衡狀態下,再向體系中充入He,重新達到平衡前v(正)>v(逆)
D.200 ℃時,向容器中充入2 mol A和1 mol B,達到平衡時,A的體積分數小于0.5
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
化學平衡常數可以用K來表示,下列關于化學平衡常數的說法中正確的是( )。
| A.K越大,反應物的轉化率越小 |
| B.K與反應物的濃度有關 |
| C.K與生成物的濃度有關 |
| D.K與溫度有關 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com